
橙花醇具有玫瑰及苹果香气,可作为香料。其结构简式如下:
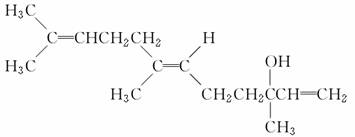
下列关于橙花醇的叙述,错误的是( )
A.既能发生取代反应,也能发生加成反应
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D.1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g溴
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断不正确的是( )
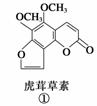
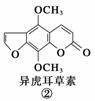
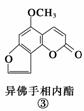
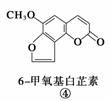
A.①与②、③与④分别互为同分异构体
B.①、③互为同系物
C.等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者多
D.①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
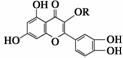 天然维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是( )
天然维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是( )
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1 mol维生素P可以和4 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述不正确的是( )
A.鱼虾放置时间过久,会产生腥臭味,应当用水冲洗,并在烹调时加入少量食醋
B.“酸可以除锈”,“洗涤剂可以去油”都是发生了化学变化
C.被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛
D.苯酚可用做杀菌消毒剂,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.工业上常用电解法制备元素C、D、E的单质
C.化合物AE、CE都是电解质,融化状态下能被电解
D.一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。
 (1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。若需规定起始时反应向逆方向进行,则c的取值范围是 。
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。若需规定起始时反应向逆方向进行,则c的取值范围是 。
⑵尿素CO(NH2)2是一种高效化肥,也是一种化工原料。密闭容器中以等物质的量NH3和CO2为原料,在1200C催化剂作用下反应生成尿素:
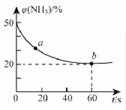
2NH3(g) + CO2(g)  CO(NH2)2 (s)+H2O(g)。混合气体中NH3的物质的量百分含量φ(NH3)随时间变化关系如右图所示。
CO(NH2)2 (s)+H2O(g)。混合气体中NH3的物质的量百分含量φ(NH3)随时间变化关系如右图所示。
则a点的正反应速率v正(CO2) b点的逆反应速率v逆(CO2)(填>、<或=); 氨气的平衡转化率是 。
⑶NH3催化氧化可得到的NO、NO2会污染环境。用间接电化学法除去NO的过程,如下图所示:
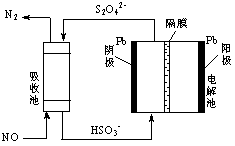
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
⑷NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;
恰好反应后,使溶液中的CO2完全逸出,所得溶呈弱碱性,则溶液中离子浓度大小关系是c(Na+)> 。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
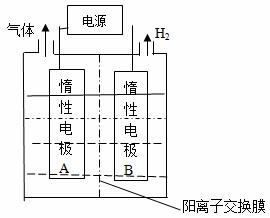
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
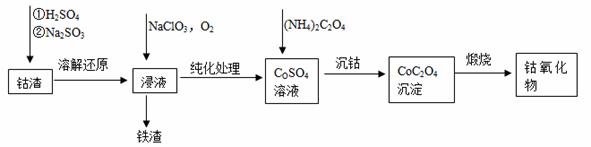
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于HC≡C― ―CH=CH CH3的说法正确的是;-------------------------------(  )
)
A.所有碳原子有可能都在同一平面上 B.最多只可能有9个碳原子在同一平面上
C.有7个碳原子可能在同一直线上 D.至少有6个碳原子在同一直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com