
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | CHl0?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++HPO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
分析 (1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(2)碳酸的酸性强于次氯酸,应用强制弱书写化学反应方程式;NaClO溶液水解呈碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,依据次氯酸根离子水解平衡常数和离子积常数、次氯酸电离平衡常数计算,Kh=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$;
(3)依据常数溶液中电离平衡常数计算氢离子浓度;
解答 解:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,则它们酸性强弱顺序是:H3PO4>CH3COOH>H2CO3>H2PO4->HClO>HCO3->HPO42-,所以酸性最强的是H3PO4,最弱的是HPO42-,故答案为:H3PO4; HPO42-;
(2)因为酸性:H2CO3>HClO>HCO3-,碳酸的酸性强于次氯酸,所以反应的离子方程式为:CO2+ClO-+H2O═HClO+HCO3-;
1.2mol•L-1的NaClO溶液中水解离子方程式为:ClO-+H2O?HClO+OH-,Kh=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{{c}^{2}(O{H}^{-})}{c(Cl{O}^{-})}$,c2(OH-)=$\frac{Kw}{Ka}$×c(ClO-)=$\frac{1{0}^{-14}}{3.0×1{0}^{-8}}$×1.2mol/L,c(OH-)=2×10-3.5mol/L,c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-3.5}}$=5×10-11.5,pH=-lg5×10-11.5=10.8,
故答案为:10.8;
(3)该温度下,0.10mol•L-1的CH3COOH溶液中存在电离平衡,CH3COOH?CH3COO-+H+,平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=1.76×10-5,c2(H+)=0.10×1.76×10-5 ,c(H+)≈1.4×10-3 mol/L,
故答案为:1.4×10-3;
点评 本题考查了弱电解质电离平衡、平衡常数计算、溶液PH计算等知识点,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.69mol/L 14.5% | B. | 8.15mol/L 15.4% | C. | 7.69mol/L 15.4% | D. | 8.17mol/L 14.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
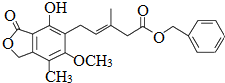 ,下列关于该化合物的说法不正确的是( )
,下列关于该化合物的说法不正确的是( )| A. | 该有机物的分子式为C23H24O6 | |
| B. | 1mol该化合物最多可以与9molH2发生加成反应 | |
| C. | 既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太大 | B. | 加热时间不够 | ||
| C. | CuSO4溶液的量不够 | D. | NaOH溶液的量不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72、1.56、6.72 | B. | 4.62、5.6、3.78 | C. | 6、8、7 | D. | 6.72、6.72、1.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
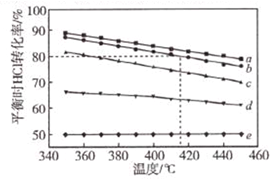 文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com