


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)=C(金刚石)△H=+1.90kJ?mol-1 可知,金刚石比石墨稳定 |
| C、一定条件下,将0 5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H═-38.6kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(Ⅰ)△H=-57.3kJ?mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2g | B、2.8g |
| C、5.6g | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
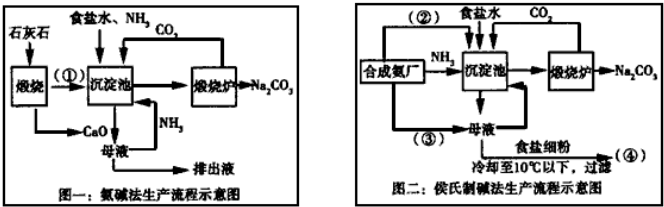
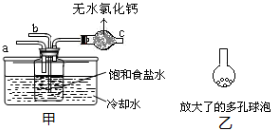
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | Ka1:4.3×10-7 Ka2:5.6×10-11 |
| A、物质的量浓度相等的溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、a mol?L-1 HCN与b mol?L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、向冰醋酸中逐滴加水至稀溶液过程中,溶液导电能力先增大,后减小 |
| D、将0.1 mol?L-1 的Na2CO3溶液逐滴加入到等浓度的HCN溶液中无明显现象,说明未反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
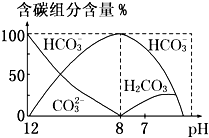 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COOH) |
| c(CH3COO-) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
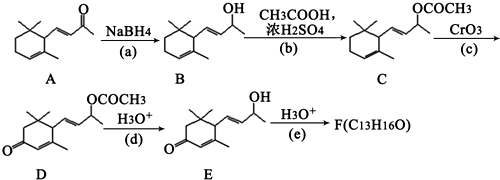
查看答案和解析>>
科目:高中化学 来源: 题型:
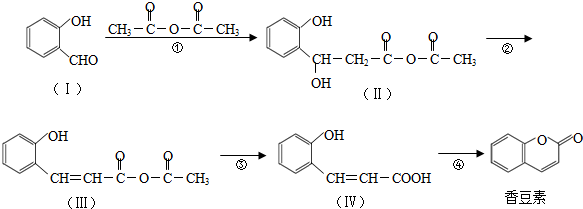
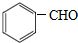 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com