

| O | - 3 |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
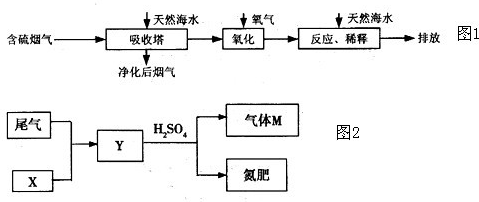
 等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______.
等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______.查看答案和解析>>
科目:高中化学 来源:2013年高考化学备考复习卷B1:非金属及其化合物(解析版) 题型:解答题

 等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______.
等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com