
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.反应③中没有元素的化合价变化;
C.反应②中Fe元素的化合价由+2价升高为+3价,N元素的化合价由+3价降低为-3价,根据电子守恒和原子守恒配平方程式;
D.Fe元素由0升高为+2、+3,n(Fe)=$\frac{16.8g}{56g/mol}$=0.3mol.
解答 解:A.氧化剂的氧化性大于氧化产物的氧化性,由①可知NaNO2的氧化性比Na2FeO2的强,由②可知NaNO2的氧化性比Na2Fe2O4的强,故A正确;
B.反应③中没有元素的化合价变化,不属于氧化还原反应,故B错误;
C.反应②中Fe元素的化合价由+2价升高为+3价,N元素的化合价由+3价降低为-3价,则配平方程式为:6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH,H2O的化学计量数是5,故C正确;
D.Fe元素由0升高为+2、+3,n(Fe)=$\frac{16.8g}{56g/mol}$=0.3mol,由三个反应可知则转移的电子为0.1mol×(2-0)+0.2mol×(3-0)=0.8mol,故D正确;
故选B.
点评 本题考查氧化还原反应,明确三个反应中元素的化合价变化是解答本题的关键,选项D为学生解答的易错点和难度,注意四氧化三铁中Fe元素的化合价,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
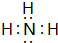 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
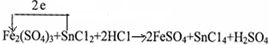 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
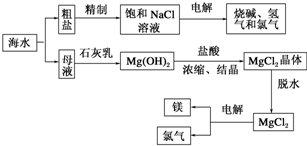
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com