用氯化铁浸出重铬酸钾(K
2Cr
2O
7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl
3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K
2Cr
2O
7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr
2O
72-+6Fe
2++14H
+=2Cr
3++Fe
3++7H
2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl
3溶液后锥形瓶中发生反应的离子方程式为
,迅速塞上胶塞的原因是
.
(2)步骤3中判断滤纸上残渣已洗净的方法是
.
(3)实验中需用到100mL浓度为0.01mol?L
-1K
2Cr
2O
7标准溶液,配置时用到的玻璃仪器有
.称量K
2Cr
2O
7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是
(填“偏高”、“偏低”、或“无影响”):滴定时,K
2Cr
2O
7溶液应置于
(填仪器名称)中.
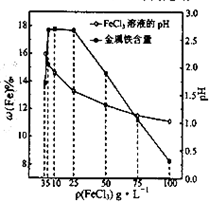
(4)科研人员确定FeCl
3溶液的最佳浓度,选用100mL不同浓度的FeCl
3溶液(FeCl
3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl
3溶液的浓度[用ρ(FeCl
3)表示]范围应为
g?L
-1,浓度过低或过高时测定结果偏低的原因分别是
.

 用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案