
【题目】向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴入几滴过氧化氢溶液后,混合溶液变成红色,则下列结论错误的是
A.该溶液中一定含有SCN![]() B.该变化中Fe2+表现出氧化性
B.该变化中Fe2+表现出氧化性
C.Fe2+与SCN![]() 不能形成红色物质D.Fe2+被过氧化氢氧化为Fe3+
不能形成红色物质D.Fe2+被过氧化氢氧化为Fe3+
科目:高中化学 来源: 题型:
【题目】某NaOH样品中含有少量Na2CO3、NaHCO3和H2O,经分析测定,其中含NaOH83.4%(质量分数,下同), NaHCO3 8.8%,Na2CO3 6.4%,H2O 1.4%。将此样品若干克投入到49克21%的稀硫酸中,待反应完全后,需加入20克9.0%的NaOH溶液方能恰好中和。则蒸发中和后的溶液可得固体质量接近于
A. 25 B. 20 C. 15 D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟对新型冠状病症状的改善有一定作用,其成分中含有“金银花”。中药“金银花”抗菌杀毒有效成分是“绿原酸”。以下是科研小组设计的“绿原酸”的合成路线:
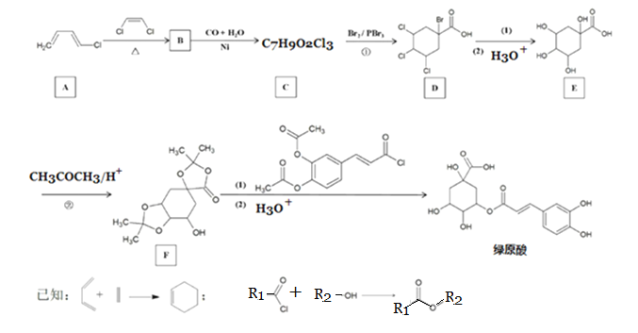
回答下列问题:
(1)有机物A的名称是__________。
(2)反应①的反应类型是__________。
(3)若碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出有机物B的结构简式,用星号(*)标出B中的手性碳__________。
(4)反应D→E中第(1)步的反应方程式是__________。
(5)有机物F中官能团的名称是__________。
(6)反应②的目的是__________。
(7)有机物C的同分异构体有多种,满足以下条件的还有______种。(不考虑立体异构)
a. 具有六元碳环结构;
b. 含有3个氯原子,且同一碳原子上只能连接一个氯原子;
c. 能与NaHCO3溶液反应产生无色无味气泡。
(8)参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线如图。
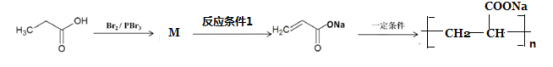
写出M结构简式__________;反应条件1为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是( )
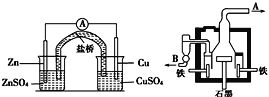
图甲 图乙
A.乙装置中B是氯气出口,A是钠出口
B.乙装置中铁极的电极反应式为:2Na-2e-=2Na+
C.甲装置中锌为负极发生还原反应,铜为正极,发生氧化反应
D.甲装置盐桥可以使反应过程中溶液保持电中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及化合物与我们的生产、生活紧密相关。
(1)Fe3+的基态核外价电子排布式为_____,应用原子结构比较 Fe 与同周期的 Mn 第三电离能(I3)的大小:I3(Mn)______I3(Fe)(填>、<、=)。理由是______。
(2)Fe、Fe2+、Fe3+可以与 CO、SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①配合物 Fe(CO)5 的熔点-20℃,沸点 103℃,可用于制备纯铁。Fe(CO)5 的结构如图所示。下列关于 Fe(CO)5 说法不正确的是____。

A.Fe(CO)5 是分子晶体
B.Fe(CO)5 中 Fe 原子的配体与C22-互为等电子体
C.Fe(CO)5 中 σ 键与 π 键之比为 1:1
D.Fe(CO)5=Fe+5CO 反应中没有新化学键生成
②CN-的电子式为_____。
③H2NCONH2(尿素)中 N、C 原子的杂化方式分别为_____、______,组成尿素的 4 种元素的第一电离能由大到小的顺序为_____,1 mol H2NCONH2(尿素) 分子中含有 σ 键的数目为_____。
(3)NaCl 和MgO 都属于离子化合物,NaCl 的熔点为 801.3 ℃,MgO 的熔点高达 2800℃。造成两种晶体熔点差距的主要原因是_____。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7 属正交晶系(长方体形)。晶胞参数为 a pm、b pm、c pm。如图为沿 y 轴投影的晶胞中所有 Cs 原子的分布图和原子分数坐标。据此推断该晶胞中Cs 原子的数目为_____。
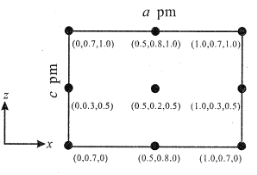
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
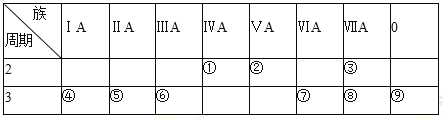
(1)①的元素符号为 _________;⑨的原子结构示意图为 _________。
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是_____________________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是_________(用化学式表示)。
(5)⑤、⑥两种元素相比较,金属性较强的是_________(填元素名称),可以验证这一结论的实验是_________(填正确选项的编号)。
A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分) 某实验小组用下图装置进行乙醇催化氧化的实验。Z.X.X.K]
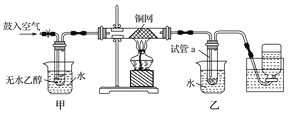
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是 反应(放热或吸热)。
(2)甲和乙两个水浴作用不相同。甲的作用是 ;
乙的作用是 。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 ,
集气瓶中收集到的气体的主要成分是 。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可先在混合液中加入 (填写字母)。然后,再通过 (填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com