
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
分析 苯的同系物的通式为CnH2n-6,C9H10的组成比苯的同系物少2个H,不含有其它环则说明该有机物侧链含有1个碳碳双键,且侧链应该含有3个C,侧链可能情况有:①1个-CH2-CH=CH2、②1个-CH=CHCH3、③-C(CH3)=CH2、④1个-CH3和-CH=CH2,前3种不存在同分异构体,④存在邻、间、对3种同分异构体,据此进行解答.
解答 解:芳香烃的分子式为C9H10比苯的同系物的通式CnH2n-6少2个H,不含有其它环则说明该有机物侧链含有1个碳碳双键;该有机物侧链总共含有9-6=3个C,侧链可能的组成情况有:①1个-CH2-CH=CH2、②1个-CH=CHCH3、③-C(CH3)=CH2、④1个-CH3和-CH=CH2,其中取代基为①②③时,该有机物各只有一种结构,当取代基为③时含有邻、间、对3种同分异构体,所以该有机物总含有6种同分异构体,
故选C.
点评 本题考查了同分异构体数目的求算,题目难度中等,注意掌握同分异构体的书写方法,正确分析该有机物苯环侧链的取代基组成情况为解答本题的关键.


科目:高中化学 来源: 题型:解答题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E的单质是日常生活中用量最大的金属材料 |
 .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
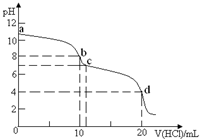 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | a点时:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | b点时:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | d点时,溶液中存在电离平衡:H2CO3?2H++CO32- | |
| D. | 由水电离产生的c(H+)大小顺序为:b<c<d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在体内完全氧化时,提供的能量比糖类和蛋白质约高一倍 | |
| B. | 利用油脂在碱性条件下水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化,即与氢气发生加成反应,可以制造植物奶油(人造奶油) | |
| D. | 天然油脂没有固定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
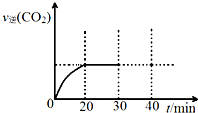 消除大气污染有多种方法.
消除大气污染有多种方法.| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 足球烯(C60)在苯中的溶解度比在乙醇中的溶解度大 | C60易溶于非极性溶剂苯而难溶于乙醇,符合相似相溶原理 |
| B | Fe3+可用SCN-检验 | 生成了Fe(SCN)3红色沉淀 |
| C | Cu(OH)2可溶于氨水 | 可生成深蓝色溶液[Cu(H2O)4]SO4 |
| D | HF的沸点高于HCl | HF的键长比HCl短 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com