
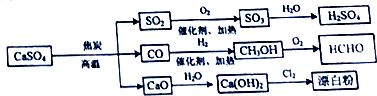
| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
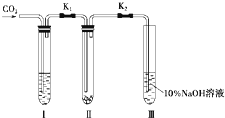 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
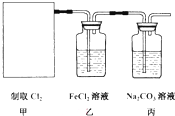
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al在氧气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| B、铜的金属活动性比铝弱,可用铜罐代替铝罐储运浓硝酸 |
| C、明矾可用于除去酸性废水中的悬浮颗粒 |
| D、用高纯度的二氧化硅制作的光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
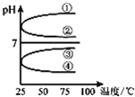 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业制漂白粉是将氯气通入石灰水中制备 |
| B、海水中提取溴的方法是在经处理得到的含溴单质的水中鼓入热空气或水蒸气使溴单质挥发出来 |
| C、硫粉在过量的纯氧中燃烧可以生成三氧化硫 |
| D、少量二氧化碳通入氯化钙溶液中能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X为金属,Y为非金属,则X和Y可能位于周期表中不同主族 |
| B、若X为非金属,Y为非金属,则X和Y一定位于周期表中同一主族 |
| C、若M、N在常温下呈气态,则X、Y不可能位于同一主族 |
| D、若在常温下,M为气态,N为固态,则X、Y可能位于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电路中每转移12 mol电子,最多有 2 mol Cr2O
| ||
| B、阳极反应为Fe-2e-═Fe2+ | ||
| C、电解过程中溶液pH增大 | ||
| D、电解过程中有Fe(OH)3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A、3 min |
| B、1 min |
| C、2 min |
| D、0 min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com