1.【化学-选修3:物质结构与性质】
(1)原高碘酸盐(IO
65-)、过二硫酸盐(S
2O
82-)、二氧化铅(PbO
2)是三种具有强氧化性的物质,均能在一定条件下将Mn
2+氧化为高锰酸盐.回答下列问题:
①基态锰原子能量最高能级电子排布图为
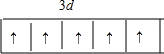
.
②过二硫酸根离子中两个硫原子间存在过氧键,写出过硫酸根离子的结构简式

.
③碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(2)利用铜萃取剂M,通过如下反应实现铜离子的富集:
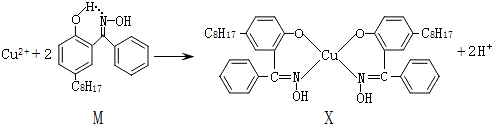
①X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
②X中以sp
2杂化、sp
3杂化的原子的第一电离能由大到小顺序为N>O>C.
③上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键 f.氢键
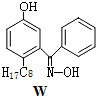
④M与W(分子结构如图)相比,M的水溶性小,更利于Cu
2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
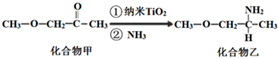
(3)纳米TiO
2是一种应用广泛的催化剂,其催化的一个实例如图.化合物乙中手性碳原子有1个,化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键.化合物乙中采取sp
3杂化的原子的电负性由大到小的顺序为O>N>C.
(4)常压下,水冷却至0℃以下,即可结晶成六方晶系的冰.日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737pm,菱形底边a=452pm,底面菱形的锐角是60°.则:冰的密度=ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{{a}^{2}•sin60°}$=$\frac{\frac{18×4}{6.02×1{0}^{23}}}{45{2}^{2}×737×0.866×(1{0}^{-10})^{3}}$=0.917 g/cm
3(代值列计算式).
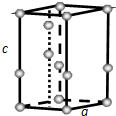

 棱长相等),其二氯代物(不考虑立体异构)有( )
棱长相等),其二氯代物(不考虑立体异构)有( )
 .
. .
.


