
| A. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
分析 A.合成氨生产中将NH3液化分离,能使反应体系中NH3的浓度降低,虽然提高了反应物的转化率,但降低了反应速率;
B.硫酸工业中在接触室安装热交换器是为了利用二氧化硫生成三氧化硫的反应是放热;
C.电解饱和食盐水时,阴极室产生的是氢气和氢氧化钠,阳极上产生的是氯气,采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室;
D.根据侯氏制碱法的原理知识来回答.
解答 解:A.合成氨生产中将NH3液化分离,能使反应体系中NH3的浓度降低,虽然提高了反应物的转化率,但降低了反应速率,故A错误;
B.硫酸工业中在接触室安装热交换器是为了利用二氧化硫生成三氧化硫的反应是放热,而不是利用SO3转化为H2SO4时放的热量,故B错误;
C.电解饱和食盐水时,阴极室产生的是氢气和氢氧化钠,阳极上产生的是氯气,采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室,故C错误;
D.向饱和食盐水中通入氨气再通入二氧化碳即可生成碳酸氢钠固体,碳酸氢钠受热分解即可得到碳酸钠,故D正确;
故选:D.
点评 本题是一道关于化学和化工知识结合的实际应用方面的考题,熟悉工业合成氨、工业制备硫酸、电解饱和食盐水、侯氏制碱法原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含钾 | |
| C. | 待检液逐滴加入NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,则原溶液中可能含有Al3+ | |
| D. | 待检液中先加入KSCN溶液,无明显现象,再加入氯水,溶液显血红色,则待检液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 含有大量ClO-的溶液中:K+、H+、I-、SO42 | |
| C. | -使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
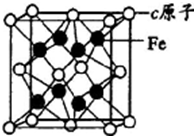 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

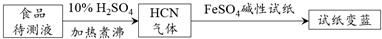
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
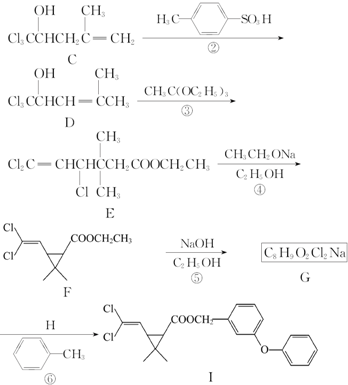
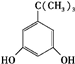 、
、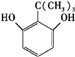 、
、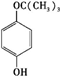 任意一种.
任意一种.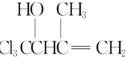 为原料合成
为原料合成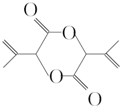 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
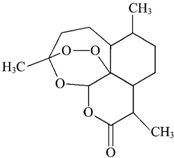
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 该有机物属于烃 | |
| C. | 分子中含有醚键、酯基、甲基三种官能团 | |
| D. | 能发生加成反应和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 | |
| D. | 微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com