
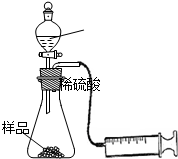
 某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:| VmL |
| 22400mL?mol-1 |
| ||
| ||
| 168×(b-c)g |
| 62 |
| 168(b-c) |
| 62 |
| ||
| 84g/mol |
| b-c |
| 31 |
| ||
| 1 |
| 2 |
| b-c |
| 62 |
| c-a |
| 106 |
| b-c |
| 62 |
| c-a |
| 106 |
| b-c |
| 62 |
| c-a |
| 106 |
| b-c |
| 62 |
| c-a |
| 106 |
| b-c |
| 62 |
| c-a |
| 106 |
| b-c |
| 62 |
| c-a |
| 106 |
| VmL |
| 22400mL?mol-1 |
| VmL |
| 22400mL?mol-1 |
| c-a |
| 106 |
| c-a |
| 106 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、原子晶体中只含有共价键 |
| B、离子晶体中只含有离子键,不含有共价键 |
| C、分子晶体中只存在分子间作用力,不含有其他化学键 |
| D、任何晶体中,若含有阳离子也一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计如图实验装置进行实验.
某兴趣小组设计如图实验装置进行实验.
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊, 则“吸收液”中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 | 则“吸收液”中存在 SO32-. |
| 步骤3: | 则“吸收液”中存在 HSO3-. |
查看答案和解析>>
科目:高中化学 来源: 题型:
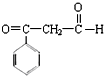 是一种重要的化工原料.A、B、C、D、E之间的转化关系如图:
是一种重要的化工原料.A、B、C、D、E之间的转化关系如图: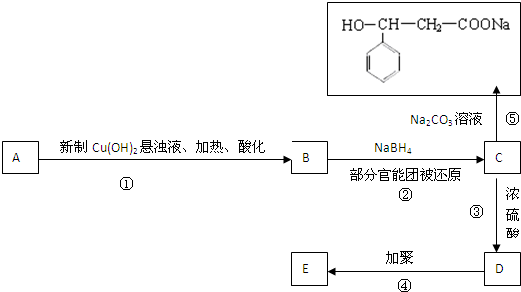
查看答案和解析>>
科目:高中化学 来源: 题型:
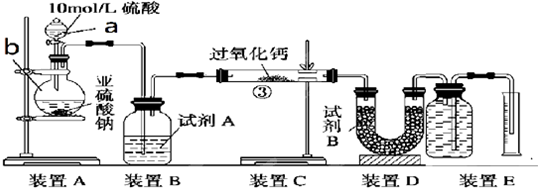
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cl-、SO42- |
| B、SO42-、Ca2+、CO32- |
| C、H+、CO32-、Cl- |
| D、Fe3+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于6.0mL |
| B、等于6.0mL |
| C、小于6.0mL |
| D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com