
【题目】比较下列各组物质的沸点,结论正确的是( )
① 丙烷<乙醇 ② 正戊烷>正丁烷 ③ 乙醇>乙二醇
A.①②
B.②③
C.①③
D.①②③
科目:高中化学 来源: 题型:
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程________.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________,其与水反应的化学方程式为________.
(4)F分子中含有6个原子,其化学式是________或________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
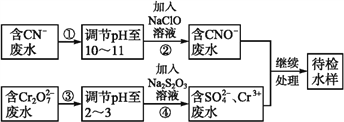
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______________。
(2)步骤④的反应为S2+Cr2O72-+H+![]() SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=____。若25 ℃时将浓度均为0.1 mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____(填字母)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)除去废水中的阳离子:取水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入一定量的Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式为_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M,常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。M属于芳香族化合物,苯环上只含有一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162g·mol-1,只含碳、氢、氧,且原子个数之比为5:5:1。
(1)肉桂酸甲酯的结构简式是______________________。
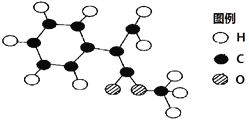
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为_________________。
(3)用芳香烃A为原料合成G的路线如下:
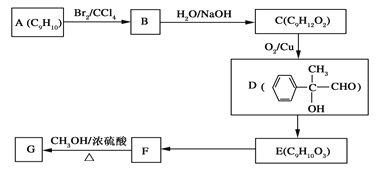
①化合物E中的官能团有________(填名称)。
②E→F的反应类型是________,
F→G的化学方程式为__________________________________________________。
③写出两种符合下列条件的F的稳定的同分异构体的结构简式_________________。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,最多消耗5mol H2;
ⅲ.它不能发生水解反应,但可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应![]() ,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是

A. T K时该反应的化学平衡常数为![]()
B. 反应在前2s的平均速率![]() mol·L-1·s-1
mol·L-1·s-1
C. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038mol·L-1,则反应的△H<0
D. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期的主族元素,原子序数依次增大,A是IA族的非金属元素,B元素的最高价氧化物的水化物与其简单气态氢化物可反应生成盐,C是短周期中原子半径最大的元素,D元素原子L层电子数和M层电子数之差等于B元素最外层电子数,E元素最高正价和最低负价代数和等于4,据此回答下列问题:
(1)F元素在周期表中的位置__________,C原子结构示意图______________。
(2)A、B两元素可形成18电子的分子,该分子的电子式为_______________。
(3)A和氧元素形成的简单化合物,其熔沸点高于A和E形成的简单化合物,原因是____________。
(4)C、D、F可形成复杂化合物C[DF4],该化合物含有的化学键类型为________________。
(5)仅有上述元素形成的化合物或单质间的某些反应,可用以说明E和F两元素非金属性的强弱,写出其中一个离子反应方程式__________________________________。
(6)写出C、D两元素最高价氧化物的水化物反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
(1)锂电池放电时电池的反应式为_____________________________。
(2)该电池工作时,Li+向________(填“正极”或“负极”)迁移。
(3)假设放电过程中消耗负极材料5.6g,则转移的电子数目为_______(NA为阿伏加德罗常数的值)。
科学家设想利用太阳能电池电解水产生的气体制成燃料电池给卫星充电,可建立环保型的卫星供电系统。
(4)已知破坏1molH-H键、1molO=O键、1molH-O键时分别需要吸收436kJ、498kJ、465kJ的能量。下图表示H2、O2转化为水的反应过程能量变化,则b=______。
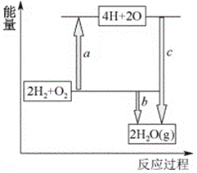
(5)若该氢氧燃料电池的电解质溶液为酸性溶液,电池总反应为2H2+O2=2H2O。该电池的正极反应为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com