
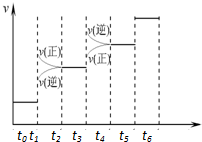
 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1.请回答:(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是增大压强.其中表示平衡混合物中NH3的含量最高的一段时是t2-t3.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1.请回答:(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是增大压强.其中表示平衡混合物中NH3的含量最高的一段时是t2-t3.分析 (1)根据图象分析影响平衡的因素,主要是反应进行方向和速率的变化特征分析;
(2)依据三行计算列式计算得到,
N2(g)+3H2(g)?2NH2(g)
开始 2mol/L 4mol/L 0
反应 1mol/L 3mol/L 2mol/L
平衡 1mol/L 1mol/L 2mol/L
(3)反应是放热反应,升温平衡逆向进行;
(4)单质硫的燃烧热为296KJ•mol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,据此书写热化学方程式;
(5)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,据此书写热化学方程式.
解答 解:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
(1)由反应速率与时间关系图象可知,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的,即表示平衡混合物中NH3的含量最高的一段时间是t2-t3,
故答案为:增大压强;t2-t3;
(2)N2(g)+3H2(g)?2NH2(g)
开始 2mol/L 4mol/L 0
反应 1mol/L 3mol/L 2mol/L
平衡 1mol/L 1mol/L 2mol/L
平衡时氢气浓度=1mol/L,
故答案为:1mol/L;
(3)已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1,反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:减小;
(4)单质硫的燃烧热为296KJ•mol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1 ;
(5))HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,
反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol.
点评 本题综合考查反应热与焓变,化学平衡和平衡常数影响因素分析,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意燃烧热、中和热概念的理解应用,题目较简单.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
 在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )
在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com