

| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
分析 A.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳不反应,浓硫酸具有吸水性;
B.碘易升华,KI加热不反应,但无法回收碘;
C.亚铁离子不稳定,易被空气氧化生成铁离子;
D.NaOH和氯气、HCl都反应.
解答 解:A.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳不反应,浓硫酸具有吸水性,所以该实验能得到干燥纯净的二氧化碳,能实现实验目的,故A正确;
B.KI加热不反应,易升华生成碘蒸气,但该装置无法回收碘,故B错误;
C.亚铁离子不稳定,易被空气氧化生成铁离子,且FeSO4•7H2O受热易分解,所以不能直接蒸干FeSO4饱和溶液来制备FeSO4•7H2O,故C错误;
D.NaOH和氯气、HCl都反应,应该用饱和食盐水除去氯气中的HCl,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、物质制备、物质分离和提纯等知识点,明确实验原理、物质性质差异性是解本题关键,注意除杂时要防止引进新的杂质,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
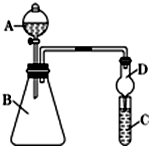 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
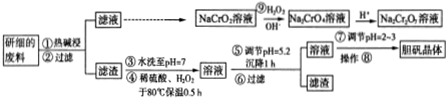
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
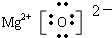 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| B. | 铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 | |
| C. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| D. | 凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 数据 编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 由表中数据可估算出HX的电离常数Ka(HX)≈10-5 | |
| B. | 向上述实验③HX反应后的溶液中加入实验①中的HY溶液前后,水的电离程度增大 | |
| C. | 表中x<7,y=7 | |
| D. | 上述向HX中加amLNaOH时,溶液中c(Na+)=c(X-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
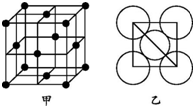 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
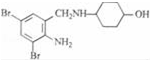 ,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)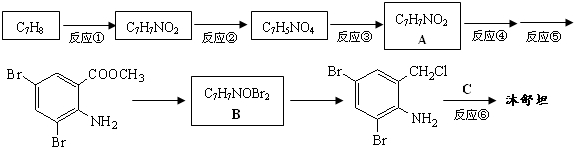
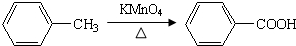 ,完成下列填空:
,完成下列填空: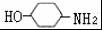 +2
+2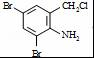 +K2CO3→2
+K2CO3→2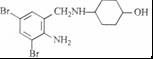 +2KCl+CO2↑+H2O.
+2KCl+CO2↑+H2O.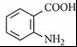 B
B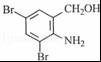 .
.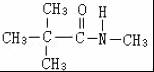 、
、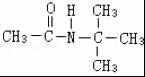 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com