
分析 以W的浓度变化表示的反应速率为0.05mol•L-1•min-1,可知生成W为0.05mol•L-1•min-1×2min×2L=0.2mol,则
2X(g)+Y(g)═nM(g)+2W(g)
开始 0.6 0.6 0 0
转化 0.2 0.1 0.1n 0.2
2min末 0.4 0.5 0.1n 0.2
容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则
$\frac{0.4+0.5+0.1n+0.2}{0.6+0.6}$=$\frac{5}{4}$,
解得n=4,
结合c=$\frac{n}{V}$、速率之比等于化学计量数之比计算.
解答 解:以W的浓度变化表示的反应速率为0.05mol•L-1•min-1,可知生成W为0.05mol•L-1•min-1×2min×2L=0.2mol,则
2X(g)+Y(g)═nM(g)+2W(g)
开始 0.6 0.6 0 0
转化 0.2 0.1 0.1n 0.2
2min末 0.4 0.5 0.1n 0.2
容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则
$\frac{0.4+0.5+0.1n+0.2}{0.6+0.6}$=$\frac{5}{4}$,
解得n=4,
(1)W与Y的化学计量数比为2:1,则前2min内用Y的浓度变化表示的平均反应速率为0.05mol•L-1•min-1×$\frac{1}{2}$=0.025mol•L-1•min-1,
故答案为:0.025mol•L-1•min-1;
(2)2min末X的浓度为$\frac{0.4mol}{2L}$=0.2mol/L,故答案为:0.2mol/L;
(3)由上述分析可知,n=4,答:方程式中n为4.
点评 本题考查化学平衡的计算,为高频考点,把握反应前后的物质的量关系、化学平衡三段法计算为解答的关键,侧重分析与计算能力的考查,注意n的确定方法,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 温度℃ | 10 | 30 | 60 | 90 |
| 浓度(mol/L) | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| … | E | A | B | ||
| C | … | D |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHClCH2CH3 2-氯丁烷 | B. | CH3COOC2H5 乙酸乙酯 | ||
| C. | CH3CH2CH (CH3)2 2-甲基丁烷 | D. | 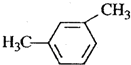 2,5-二甲苯 2,5-二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四项 | B. | 三项 | C. | 二项 | D. | 一项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
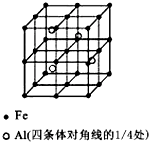 一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:
一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com