(1)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图所示.
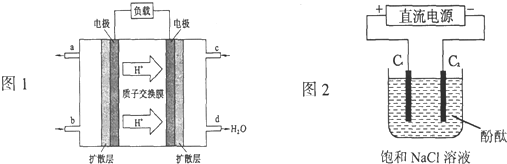
①请写出从C口通入O
2发生的电极反应式
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
.
②以石墨电极电解饱和食盐水,电解开始后在
阴极
阴极
的周围(填“阴极”或“阳极”)先出现红色.假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为
5.8×1023
5.8×1023
(保留两位有效数字).
(2)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H<0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H
2O 投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L
-1)变化如下:
|
0min |
5min |
10min |
| CO |
0.01 |
|
0.0056 |
| H2O |
0.01 |
|
0.0156 |
| CO2 |
0 |
|
0.0044 |
| H2 |
0 |
|
0.0044 |
①请分别计算CO和CO
2的平衡浓度
0.006 mol?L-1
0.006 mol?L-1
,
0.004 mol?L-1
0.004 mol?L-1
.
②CO的平衡转化率为
40%
40%
,欲提高CO的转化率,下列措施中可行的是
be
be
(填序号).
a.增加压强 b.降低温度 c.体积不变,再充入CO d.更换催化剂 e.体积不变,再充入0.1molH
2O
③若5min~10min只改变了某一条件,该条件是
H2O的浓度
H2O的浓度
,如何改变的
增大了0.01 mol?L-1
增大了0.01 mol?L-1
.




 中考解读考点精练系列答案
中考解读考点精练系列答案