
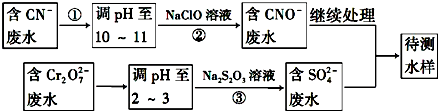
分析 (1)氰化钠易发生水解产生氰化氢;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,结合质量守恒书写化学方程式;
(4)含CN-废水调节溶液pH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调节溶液pH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得到待测水样.
①由上述分析可知,处理废水流程中主要使用的方法是氧化还原反应;
②碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子;
③利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式.
解答 解:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠,方程式为NaCN+H2O2+H2O═NaHCO3+NH3↑,故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,反应的方程式为3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O,
故答案为:3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O;
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
①从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化-还原法;
故答案为:d;
②步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
③每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
点评 本题考查物质的分离和提纯,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及实验基本操作、氧化还原反应等知识点,明确流程图中化学反应原理、基本操作方法是解本题关键,难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中的乙烯,将气体通入酸性 KMnO4溶液 | |
| B. | 除去溴苯中的溴,加入 KI 溶液后分液 | |
| C. | 除去 CH2Cl2 中的 HCl,加水分液 | |
| D. | 除去硝基苯中的苯,加水分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
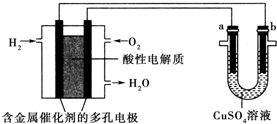
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | 此装置用于铁表面镀铜时,a为铁 | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②④③① | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、天然气等燃烧产生大量二氧化碳 | |
| B. | 大量燃烧含硫量高的煤产生二氧化硫 | |
| C. | 森林遭到乱砍烂伐,破坏了生态环境 | |
| D. | 各种机动车排放的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com