
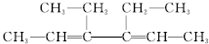
分析 (1)烯烃命名时,要选含官能团的最长碳链为主链,从离官能团近的一端开始编号,用编号较小的碳原子代表官能团的位置;根据氢化后产物的结构来分析等效氢,从而得出一氯代物的种类;
(2)根据互为同分异构体的物质必须分子式相同而结构不同,能使酸性高锰酸钾溶液和溴水褪色说明结构中含不饱和键,其一氯取代物只有一种结构说明物质的结构非常对称,据此分析.
解答 解:(1)烯烃命名时,要选含官能团的最长碳链为主链,故选横着的碳链为主链,主链上有2条双键和6个碳原子,故为己二烯;从离官能团近的一端开始编号,用编号较小的碳原子代表官能团的位置,则在3号和4号碳上各有一个乙基,故名称为:3,4-二乙基-2,4-己二烯;氢化后产物变为3,4-二乙基己烷,氢原子只有三类,从而得出一氯代物有3种,故答案为:3,4-二乙基-2,4-己二烯;3;
(2)根据互为同分异构体的物质必须分子式相同而结构不同,故B的分子式应为C10H18,含2个不饱和度,能使酸性高锰酸钾溶液和溴水褪色说明结构中含不饱和键,其一氯取代物只有一种结构说明物质的结构非常对称,故结构简式为:(CH3)3CC≡CC(CH3)3,故答案为:(CH3)3CC≡CC(CH3)3.
点评 本题考查了有机物的命名和同分异构体的书写,难度不大,同分异构体的书写是高考热点,应注意加强训练.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:填空题
 将等物质的量的Cl2和CH4混合气体A.
将等物质的量的Cl2和CH4混合气体A.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 | |
| C. | 常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 | |
| D. | 如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com