
【题目】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:
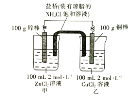
(1)反应过程中,______棒质量增加。
(2)总反应的离子方程式为_____。
(3)反应中,当其中一个电极质量变为102g时,另一电极质量______________(填大于、小于或等于)98g。
(4)反应过程中,盐桥中的________ 离子进入甲杯。
(5)当外电路中转移0.2mol电子时,乙烧杯中浓度最大的阳离子是_________,其物质的量浓度为_______________。(假设溶液体积不变)
【答案】铜 Zn+Cu2+=Zn2++Cu 小于 Cl- NH4+ 2mol/L
【解析】
该装置为原电池装置,Zn棒为负极,发生Zn-2e-=Zn2+,Cu为正极,发生Cu2++2e-=Cu。
(1)反应中,Cu棒作正极,发生Cu2++2e-=Cu,质量增加;
(2)Zn作负极,发生Zn-2e-=Zn2+,则总离子方程式为Zn+Cu2+=Zn2++Cu;
(3)电极质量增加的一极为Cu棒,增加2g时,转移电子为![]() ×2mol,则Zn减少的质量为
×2mol,则Zn减少的质量为![]() ×65g>2g,则剩余质量小于98g;
×65g>2g,则剩余质量小于98g;
(4)电池的内电路中,阳离子向正极移动,阴离子向负极移动,盐桥中氯离子移向甲杯;
(5)当外电路中转移0.2mol电子时,乙溶液中Cu2+减少为0.1mol,NH4+增加0.2mol,则乙中阳离子最多的为NH4+,其浓度=0.2mol/0.2L=2mol/L。


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O(g)=CO(g)ΔH1 ; C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2 (g)=SO2 (g) ΔH3 ; S(g)+O2 (g)=SO2 (g) ΔH4
③H2(g)+ ![]() O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol·L-1的稀H2SO4100mL,配制过程中可能用到下列仪器:
①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是
A. ②⑥③⑦⑤ B. ④③⑤⑦⑥ C. ①③⑦⑤⑥ D. ②⑤⑦⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
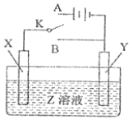
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为粗铜片,Y为精铜,Z为CuSO4,将开关K置于A处,一段时间后CuSO4溶液的浓度减小
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为H2SO4,将开关K置于A处,一段时间后H2SO4的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( )

A. 溶液中c(SO42+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有Cl2产生,发生还原反应
D. 反应初期,X电极周围出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,6.72LHCl气体溶于50mL水再配成250mL溶液,
(1)求溶质的物质的量_________
(2)求所得盐酸的物质的量浓度____________?
(3)若将此溶液再稀释成1.5 L溶液,求稀释后盐酸的物质的量浓度______________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,微溶于浓KOH溶液;在酸性或中性溶液中不稳定,在0~5℃的强碱性溶液中较稳定。某实验小组欲制备高铁酸钾并测定其纯度。
Ⅰ.制备高铁酸钾(夹持装置略)
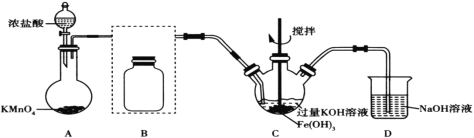
(1)装置A为氯气发生装置,其中盛放高锰酸钾的仪器名称为__。
(2)将除杂装置B补充完整并标明所用试剂__。
(3)装置C中Cl2与Fe(OH)3、KOH反应生成K2FeO4的化学方程式是____。
(4)实验时将装置C置于冰水浴中,其原因是____。
(5)实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是____。
Ⅱ.测定产品纯度
(6)将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
①Cr(OH)4+ FeO42-=Fe(OH)3↓+CrO42-+OH,
②_______,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
该粗产品中K2FeO4的质量分数为__(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是

A. 能和碳酸钠溶液反应的官能团有2种
B. 1mol该有机物最多能与2molH2发生加成
C. 与![]() 互为同分异构体
互为同分异构体
D. 既可以发生取代反应又可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁杉脂素是重要的木脂素类化合物,其结构简式如图所示。下列有关铁杉脂素的说法正确的是( )
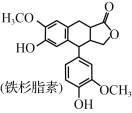
A.分子中有3个手性碳原子
B.能与甲醛发生缩聚反应
C.分子中所有的碳原子可能处于同一平面
D.1mol铁杉脂素与NaOH溶液反应最多消耗4molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com