
| A | B | C | D |
x溶液/mol·L-1 | 0.150 | 0.090 | 0.080 | 0.040 |
y溶液/mol·L-1 | 0.050 | 0.030 | 0.160 | 0.120 |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
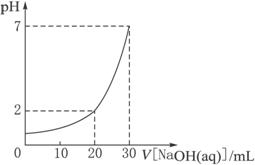
 某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验.请回答:
| ||
| ||
| 125(a-b) |
| 4V |
| 125(a-b) |
| 4V |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 106y |
| 197x |
| 106y |
| 197x |
查看答案和解析>>
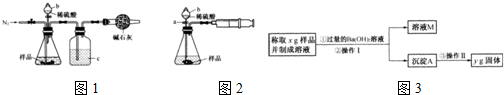
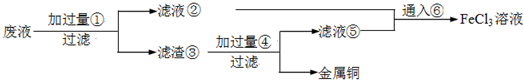
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
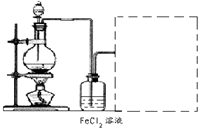
科目:高中化学 来源: 题型:
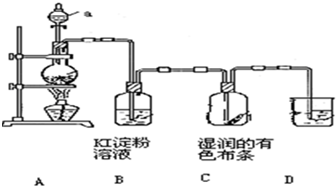 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com