
 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:不详 题型:填空题
 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。 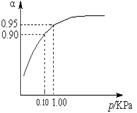
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )
2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )| A.v(H2)=v(NH3) | B.v(N2)=2v(NH3) |
| C.v(NH3)=v(H2) | D.v(H2)=3v(N2) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
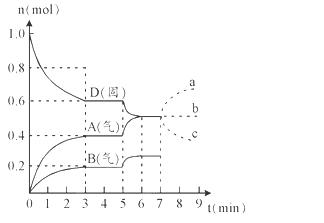
 HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/ mol | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间 范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率 /(10-3 mol·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。
2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。| | A | B | ||
| 研究 目的 | 压强对反应的影 响(p2>p1) | 温度对反应的影响 | ||
| 图示 |  | 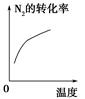 | ||
| | C | D | | |
| 研究 目的 | 平衡体系增加N2 对反应的影响 | 催化剂对反应的影响 | | |
| 图示 | 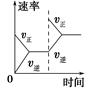 | 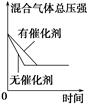 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

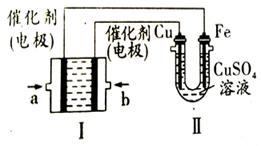
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
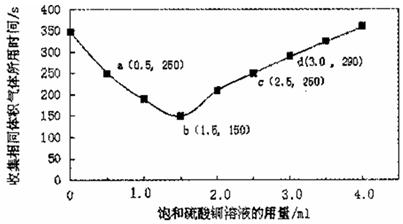
| A.饱和硫酸铜溶液用量过多不利于更快收集氢气 |
| B.a ,c两点对应的氢气生成速率相等 |
| C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1 |
| D.d点没有构成原电池,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
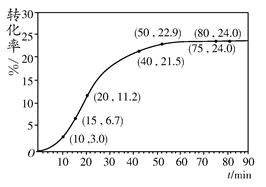
 NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
| A.0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B.c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1 |
| D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com