
分析 (1)任何电解质溶液中都存在OH-、H+,如果溶液中只存在一种溶质,根据溶液中存在的离子知,溶质只能是氯化铵,NH4+水解导致其溶液呈酸性,但水解程度较小;
(2)若上述关系中④是正确的,c(OH-)>c(H+)则溶液呈碱性,氯化铵溶液呈酸性,要使混合溶液呈碱性,则溶液中溶质为一水合氨和氯化铵;
(3)溶液显中性,所以c(H+)=c(OH-),溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故c(NH4+)=c(Cl-),氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量;电离常数只与温度有关,结合电离常数Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:(1)溶液中只存在OH-、H+、NH4+、Cl-四种离子,任何水溶液中均存在OH-和H+,所以去掉OH-和H+,剩下的离子就是溶质产生的,因此①中溶质为氯化铵
可能为NH4Cl溶液,因NH4+水解而显酸性,溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:氯化铵;A;
(2)若上述关系中④是正确的,c(OH-)>c(H+)则溶液呈碱性,氯化铵溶液呈酸性,要使混合溶液呈碱性,溶液中一水合氨电离程度大于铵根离子水解程度,所以该溶液中溶质为NH4Cl、NH3•H2O,
故答案为:NH4Cl、NH3•H2O;
(3)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,氨水过量,则混合前a>b,溶液显中性,所以c(H+)=c(OH-),溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故c(NH4+)=c(Cl-),溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=c(Cl-)=$\frac{b}{2}$mol/L,混合后反应前c(NH3•H2O)=$\frac{a}{2}$mol/L,则反应后c(NH3•H2O)=($\frac{a}{2}$-$\frac{b}{2}$)mol/L,
则k=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{b}{2}×1×1{0}^{-7}}{\frac{a}{2}-\frac{b}{2}}$=$\frac{b×1{0}^{-7}}{a-b}$.
故答案为:>;$\frac{b×1{0}^{-7}}{a-b}$.
点评 本题以离子浓度大小比较为载体考查溶液中溶质判断,明确溶质的性质是解本题关键,再结合离子浓度相对大小确定溶质,熟练掌握离子浓度大小比较方法,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0;使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 图②表示25℃时,用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 图③表示CH4(g)+H2O(g)?CO(g)+3H2(g)△H,反应CH4的转化率与温度、压强的关系,且P1>P2、△H>0 | |
| D. | 图④中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0;正、逆反应的平衡常数K随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
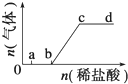 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、SCN-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:SO32-、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2| A. | 曲线3表示的微粒是SO32- | |
| B. | 溶液pH=4.2时,c(Na+)+c(H+)=c(OH-)+2c(SO32-) | |
| C. | 常温下,$\frac{{K}_{a1}}{{K}_{a2}}$=1000 | |
| D. | 溶液pH=1.2时:c(Na+)+c(H+)=c(OH-)+c(HSO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁和钢都属于合金 | |
| B. | 明矾可用作混凝剂去除水中的悬浮物 | |
| C. | 食盐水、稀豆浆、糖水都能产生丁达尔效应 | |
| D. | 以次氯酸钠为有效成分的漂白液可为泳池消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式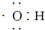 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水杀菌 | |
| D. | 原子结构示意图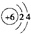 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性 H2O<NH3<CH4 | B. | 微粒半径 Al3+<F-<Cl- | ||
| C. | 碱性 Mg(OH)2<NaOH<KOH | D. | 熔点 冰醋酸<食盐<金刚石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com