
 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。 2SO3(g) ΔH=?196.6 kJ·mol–1
2SO3(g) ΔH=?196.6 kJ·mol–1 2NO2(g) ΔH=?113.0 kJ·mol–1
2NO2(g) ΔH=?113.0 kJ·mol–1 CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。| 容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
| ② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
 SO3(g)+NO(g) △H=-41.8kJ/mol(2分)②bd(2分)
SO3(g)+NO(g) △H=-41.8kJ/mol(2分)②bd(2分)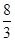 (2分) (3)>(2分)
(2分) (3)>(2分) 7N2+12H2O可知,NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以当转移1.2mol电子时,消耗的NO2的物质的量是1.2mol÷4=0.3mol,则在标准状况下的体积是0.3mol×22.4L/mol=6.72L。
7N2+12H2O可知,NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以当转移1.2mol电子时,消耗的NO2的物质的量是1.2mol÷4=0.3mol,则在标准状况下的体积是0.3mol×22.4L/mol=6.72L。 2SO3(g) ΔH=?196.6 kJ·mol–1,②2NO(g)+O2(g)
2SO3(g) ΔH=?196.6 kJ·mol–1,②2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1,则根据盖斯定律可知(①-②)÷2即得到反应NO2(g)+SO2(g)
2NO2(g) ΔH=?113.0 kJ·mol–1,则根据盖斯定律可知(①-②)÷2即得到反应NO2(g)+SO2(g) SO3(g)+NO(g),所以该反应的反应热△H=(?196.6 kJ/mol+113.0 kJ/mol)÷2=-41.8kJ/mol。
SO3(g)+NO(g),所以该反应的反应热△H=(?196.6 kJ/mol+113.0 kJ/mol)÷2=-41.8kJ/mol。 SO3(g)+NO(g)
SO3(g)+NO(g)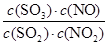 =
=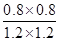 =
=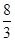 。
。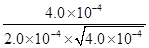 =100。根据容器②中物质的浓度可知,此时
=100。根据容器②中物质的浓度可知,此时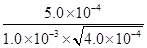 =25<100,所以反应向正反应方向进行,则υ(正)>υ(逆)。
=25<100,所以反应向正反应方向进行,则υ(正)>υ(逆)。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题

| A.x=0.5,a=8 | B.x=0.5,a=10 |
| C.x=1.5,a=8 | D.x=1.5,a=10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mol
mol mol
mol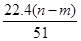 L
L +
+ )mol
)mol| A.5项 | B.4项 | C.3项 | D.2项 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当转移1mol电子时,消耗56g S2O32- |
| B.在反应中硫元素被氧化,铁元素被还原 |
| C.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| D.每生成1mol Fe3O4,转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: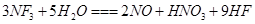 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是A. 是还原剂 是还原剂 |
B. 非极性分子,在潮湿空气中泄漏会看到红棕色气体 非极性分子,在潮湿空气中泄漏会看到红棕色气体 |
| C.每消耗0.2mol氧化剂,可收集到5.418L气体 |
D.若生成1mol  个电子 个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M | B.M+ | C.M2+ | D.M3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2:1 |
| C.若生成0.2molHNO3,则转移0.2mol电子 |
| D.若1molNF3被氧化反应转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com