
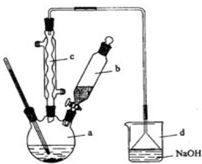
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
分析 (1)苯与液溴反应生成HBr,HBr与水蒸气结合呈白雾;HBr与液溴易挥发,而苯的卤代反应是放热的,尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(2)溴苯中含有溴,加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,据此解答;
(3)反应后得到的溴苯中溶有少量苯杂质,依据它和溴苯的性质不同除杂;
(4)根据制取溴苯所加的液体的体积进行解答;
(5)根据题意,a中有铁粉、液溴和苯,铁和溴 反应生成溴化铁,在溴化铁作催化剂的条件下,溴与苯反应生成溴苯.
解答 解:(1)苯与液溴反应生成HBr,HBr与水蒸气结合呈白雾;HBr与液溴都易挥发,而苯的卤代反应是放热的,尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,
故答案为:HBr;吸收HBr和Br2;
(2)②溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中.
故答案为:除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是,无水氯化钙能干燥溴苯,
故答案为:干燥;
(3)反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,
故答案为:苯;C;
(4)操作过程中,在a中加入12mL无水苯,向a中加入10mL水,在b中小心加入8.0mL液态溴,所以a的容积最适合的是50mL,
故答案为:B;
(5)根据题意,a中有铁粉、液溴和苯,铁和溴 反应生成溴化铁,在溴化铁作催化剂的条件下,溴与苯反应生成溴苯,反应的方程式为2Fe+3Br2=2FeBr3、C6H6+Br2$\stackrel{FeBr_{3}}{→}$ C6H5Br+HBr,
故答案为:2Fe+3Br2=2FeBr3、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
点评 本题考查物质制备实验及产率的计算,为高频考点,明确实验原理是解本题关键,知道实验操作步骤及基本操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| B. | 1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA | |
| C. | 电解精炼铜时,若转移了NA个电子,则阳极质量减小32g | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
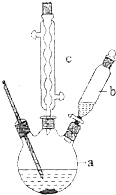 苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线:
苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线: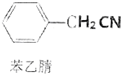 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$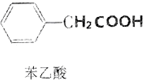 +NH4HSO4
+NH4HSO4查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “低碳经济”已成为科学家研究的主要课题之一.
“低碳经济”已成为科学家研究的主要课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热后在空气中冷却称量固体 | B. | 晶体中含有加热易挥发的杂质 | ||
| C. | 实验所取晶体已有部分脱水 | D. | 晶体加热时脱水不完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com