
 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:| n |
| V |
| 5 |
| 2 |
| 0.024g |
| 20cm3 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
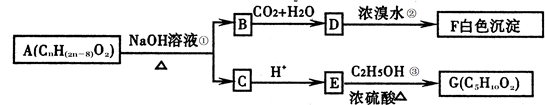
查看答案和解析>>
科目:高中化学 来源: 题型:
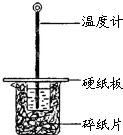 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3;0.1 |
| B、5;0.2 |
| C、3<x<5;0.1 |
| D、3<x<5;0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
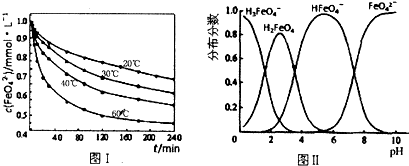
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、CO32-、SO42-、H+ |
| B、K+、OH-、H+、Cl- |
| C、Mg2+、H+、NO3-、SO42- |
| D、Fe3+、K+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
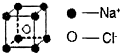
| A、1mol白磷晶体中含有的P-P键的个数为4NA |
| B、12g金刚石中含有的C-C键的个数为1.5NA |
| C、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| D、1mol氯化钠(晶胞如图)中含有Na+数目为8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com