
| A. | 容器内H2O(g)、CO、H2物质的量相等 | B. | 容器内气体的密度不再改变 | ||
| C. | 生成n mol CO的同时生成n mol H2 | D. | v正(H2O)=v正(CO) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、容器内H2O(g)、CO、H2物质的量相等,并不是不变,故A错误;
B、容器内气体的密度不再改变,说明气体的质量不变,反应达平衡状态,故B正确;
C、生成n mol CO的同时生成n mol H2,都体现正反应方向,未体现正与逆的关系,故C错误;
D、v正(H2O)=v正(CO),都体现正反应方向,未体现正与逆的关系,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 容量瓶中原来留有一点蒸馏水,没有干燥 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 乙醇与浓硫酸在140℃时共热:CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$ | |
| D. | 用18O标记的乙醇与乙酸发生酯化反应:C2H518OH+CH3COOH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 利用如图装置可验证同主族元素非金属性的变化规律.
利用如图装置可验证同主族元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
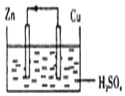
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | X和Y两种元素可形成多种二元化合物 | |
| C. | X、Z和W三种元素形成的化合物属于强电解质 | |
| D. | 元素的非金属性:X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com