
ĄŸÌâÄżĄżżÉÄæ·ŽÓŠ2AŁšgŁ©+3BŁšgŁ©4CŁšgŁ©+DŁšgŁ©ŁŹÒŃÖȘÆđÊŒĆš¶ÈcŁšAŁ©=4molmol©1 ŁŹ cŁšBŁ©=3molmol©1 ŁŹ CĄąDĆš¶ÈŸù”ÈÓÚ0ŁŹ·ŽÓŠżȘÊŒ2ĂëșóŽï”œÆœșâŚŽÌŹŁŹŽËʱD”ÄÆœșâĆš¶ÈÎȘ0.5molL©1 ŁŹ ÔòÏÂÁĐË”·šČ»ŐęÈ·”ÄÊÇŁšĄĄĄĄŁ©
A.·ŽÓŠËÙÂÊvŁšCŁ©=1molL©1s©1
B.C”ÄÆœșâĆš¶ÈÎȘ4 molL©1
C.A”ÄŚȘ»ŻÂÊÎȘ25%
D.B”ÄÆœșâĆš¶ÈÎȘ1.5 molL©1
ĄŸŽđ°žĄżB
ĄŸœâÎöĄżÀûÓĂÈę¶ÎÊœ·šŒÆËăŁș
2AŁšgŁ©+ | 3BŁšgŁ© | 4CŁšgŁ©+ | DŁšgŁ© | |
ÆđÊŒŁšmol/LŁ© | 4 | 3 | 0 | 0 |
ŚȘ»ŻŁšmol/LŁ© | 1 | 1.5 | 2 | 0.5 |
Æœș⣚mol/LŁ© | 3 | 1.5 | 2 | 0.5 |
AŁź·ŽÓŠËÙÂÊvŁšCŁ©= ![]() =1mol/ŁšLŁźsŁ©ŁŹčÊAČ»·ûșÏÌâÒ⣻
=1mol/ŁšLŁźsŁ©ŁŹčÊAČ»·ûșÏÌâÒ⣻
BŁźC”ÄÆœșâÎȘĆš¶ÈÎȘ2mol/LŁŹčÊB·ûșÏÌâÒ⣻
CŁźA”ÄŚȘ»ŻÂÊÎȘ ![]() =25%ŁŹčÊCČ»·ûșÏÌâÒ⣻
=25%ŁŹčÊCČ»·ûșÏÌâÒ⣻
DŁźB”ÄÆœșâĆš¶ÈÎȘ1.5mol/LŁŹčÊDČ»·ûșÏÌâÒ⣟
čÊŽđ°žÎȘŁșBŁź
žùŸĘÈę¶ÎÊœŒÆËăÆœșâșóžöÎïÖÊ”ÄÎïÖÊ”ÄÁżĆš¶ÈŁŹÈ»șóœűĐĐŒÆËăŒŽżÉ.


 ÔĶÁżìł”Ï”ÁĐŽđ°ž
ÔĶÁżìł”Ï”ÁĐŽđ°ž
| Äꌶ | žßÖĐżÎłÌ | Äꌶ | łőÖĐżÎłÌ |
| žßÒ» | žßÒ»Ăâ·ŃżÎłÌÍÆŒöŁĄ | łőÒ» | łőÒ»Ăâ·ŃżÎłÌÍÆŒöŁĄ |
| žß¶ț | žß¶țĂâ·ŃżÎłÌÍÆŒöŁĄ | łő¶ț | łő¶țĂâ·ŃżÎłÌÍÆŒöŁĄ |
| žßÈę | žßÈęĂâ·ŃżÎłÌÍÆŒöŁĄ | łőÈę | łőÈęĂâ·ŃżÎłÌÍÆŒöŁĄ |
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÉèNAÎȘ°ą·üŒÓ”ÂÂȚłŁÊę”ÄÖ”ĄŁÏÂÁĐĐđÊöŐęÈ·”ÄÊÇŁš Ł©
A. ÊÒÎÂÏÂŁŹ1LpH=13”ÄNaOHÈÜÒșÖĐŁŹÓÉËź”çÀë”ÄOH-ÀëŚÓÊęÄżÎȘ0.1NA
B. 1molÏő»ù(-NO2)Óë46g¶țŃő»Ż”ȘËùșŹ”Ä”çŚÓÊęŸùÎȘ23NA
C. 16Łź2g14C10H22ÖĐșŹÓĐ”ÄčČŒÛŒüÊęÄżÎȘ3.2NA
D. ÏòșŹ1molFeI2”ÄÈÜÒșÖĐÍšÈë1molCl2łä·Ö·ŽÓŠŁŹžĂ·ŽÓŠŚȘÒÆ”çŚÓÊęÎȘ3NA
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÏÂÁĐË”·šÖĐŐęÈ·”ÄÊÇŁš Ł©
A.ÓÉHÔŚÓĐÎłÉ1molH©HŒüÒȘÎüÊŐÈÈÁż
B.ËùÓĐÈŒÉŐ·ŽÓŠ¶ŒÊÇ·ĆÈÈ·ŽÓŠ
C.ÔÚÏĄÈÜÒșÖĐŁŹ1molËáÓë1molŒî·ąÉúÖĐșÍ·ŽÓŠÉúłÉËźÊ±ËùÊÍ·Ć”ÄÈÈÁżłÆÎȘÖĐșÍÈÈ
D.·ČŸŒÓÈȶű·ąÉú”Ä»ŻŃ§·ŽÓŠ¶ŒÊÇÎüÈÈ·ŽÓŠ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżșŁËźÊÇÒ»žöŸȚŽó”Ä»ŻŃ§ŚÊÔŽ±ŠżâŁŹÀûÓĂșŁËźżÉÒÔ»ń”ĂșÜ¶à»Żč€ČúÆ·ĄŁ
Łš1Ł©șŁËź”»Ż”Ä·œ·šÓĐŐôÁ󷚥ą________________(Ìî1ÖÖ·œ·š)ĄŁ
Łš2Ł©șŁËźÖÆ”Ă”Ä±„șÍÂÈ»ŻÄÆÈÜÒșżÉÒÔÀûÓĂ”çœâ·šÖ±œÓÖÆÈĄŽÎÂÈËáÄÆŁŹÖÆÈĄ”ÄÀëŚÓ·œłÌÊœÎȘ___________ĄŁ
Łš3Ł©ÀûÓĂÖÆŃÎșó”ÄŃαÌáÈĄäć”Äč€ÒŐÁśłÌÈçÏÂ(Čż·ÖČÙŚśșÍÌőŒțÒŃÂÔÈ„):
![]()
œ«Br2ÓëNa2CO3·ŽÓŠ”Ä»ŻŃ§·œłÌÊœČčłäÍêŐû:______________
ĄőBr2+ĄőNa2CO3==ĄőNaBrO3+Ąő_____+Ąő______
Łš4Ł©ŃαŐô·ąÀäÈŽșóÎöłö±żé”ÄÖśÒȘłÉ·ÖÊÇMgCl2ŁŹŽËÍâ»čșŹFe2+ĄąFe3+ĄąMn2+”ÈÀëŚÓĄŁÒÔ±żéÎȘÔÁÏÖÆ”ĂĂŸ”Äč€ÒŐÁśłÌÈçÏÂ(Čż·ÖČÙŚśșÍÌőŒțÒŃÂÔÈ„)Łș
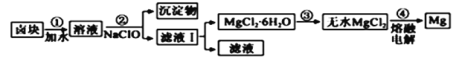
ŒșÖȘ:łŁÎÂÏÂ0.010mol/LœđÊôÀëŚÓÔÚȻ͏pHÏ”ijÁ”íÇéżöÈçÏÂ:
ÎïÖÊ | żȘÊŒłÁ”í | łÁ”íÍêÈ« |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 |
ąÙČœÖèąÚÖĐĐèżŰÖÆpH=9.8ŁŹÆäÄż”ÄÊÇ_________________________ĄŁ
ąÚÓĂNaClOŃő»ŻFe2+”Ă”œFe(OH)3łÁ”í”ÄÀëŚÓ·ŽÓŠ·œłÌÊœÎȘ___________________ĄŁ
ąÛČœÖèąÛżÉÒÔœ«SOCl2ÓëMgCl2Ą€6H2O»ìșÏŒÓÈÈÖÆÈĄÎȚËźMgCl2ŁŹSOCl2”ÄŚśÓĂÊÇ___________ĄŁ
ąÜNaClO»čÄÜłęÈ„ŃαÖĐ”ÄCO(NH2)2ŁŹÉúłÉŃÎșÍÄÜČÎÓëŽóÆűŃ»·”ÄÎïÖÊĄŁłęÈ„0.2molCO(NH2)2ʱÏûșÄNaClO__________gĄŁ
ąĘÈçčûłÁ”í0.010mol/LMgCl2ÈÜÒșŁŹžùŸĘ±ížńÖĐ”ÄÊęŸĘŒÆË㣏”±pH=11.2ʱÈÜÒșÖĐc(Mg2+)=____mol/LĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄż¶Ą±œÌȘÊÇÎÒčúŚÔÖśŃĐ·ą”ÄÒ»ÀàÓĂÓÚÖÎÁÆŒ±ĐÔȱŃȘĐÔÄÔŚäÖĐ”ÄĐÂÒ©ĄŁșÏłÉ¶Ą±œÌȘ(J) ”ÄÒ»ÖÖ·ÏßÈçÏÂ:
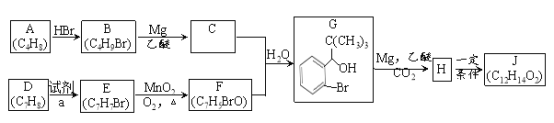
ÒŃÖȘ: 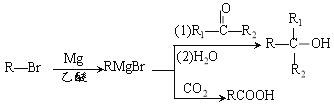
»ŰŽđÏÂÁĐÎÊÌâ:
Łš1Ł©A”ÄĂûłÆÊÇ______________________________ĄŁ
Łš2Ł©BÉúłÉA”Ä»ŻŃ§·œłÌÊœ____________________________ĄŁ
Łš3Ł© DÉúłÉE”Ä·ŽÓŠÀàĐÍÎȘ_____________ŁŹÊÔŒÁaÊÇ_______________________ĄŁ
Łš4Ł© F ”ÄœáččŒòÊœ__________________________ĄŁ
Łš5Ł©JÊÇÒ»ÖÖő„ŁŹ·ÖŚÓÖĐłę±œ»·Íâ»čșŹÓĐÒ»žöÎćÔȘ»·ĄŁĐŽłöHÉúłÉJ ”Ä»ŻŃ§·œłÌÊœ___________ĄŁ
Łš6Ł©![]() XŁŹX”ÄÍŹ·ÖÒìččÌćÖĐŁșąÙÄÜ·ąÉúÒűŸ”·ŽÓŠŁ»ąÚÄÜÓëÂÈ»ŻÌúÈÜÒș·ąÉúÏÔÉ«·ŽÓŠĄŁÂúŚăÉÏÊöÌőŒț”ÄX ”ÄÍŹ·ÖÒìččÌćčČÓĐ_____ÖÖĄŁ
XŁŹX”ÄÍŹ·ÖÒìččÌćÖĐŁșąÙÄÜ·ąÉúÒűŸ”·ŽÓŠŁ»ąÚÄÜÓëÂÈ»ŻÌúÈÜÒș·ąÉúÏÔÉ«·ŽÓŠĄŁÂúŚăÉÏÊöÌőŒț”ÄX ”ÄÍŹ·ÖÒìččÌćčČÓĐ_____ÖÖĄŁ
Łš7Ł©ÀûÓĂÌâÖĐĐĆÏąșÍËùѧÖȘʶŁŹĐŽłöÒÔŒŚÍéșÍ»ŻșÏÎïDÎȘÔÁÏŁŹșÏłÉ![]() ·ÏßÁśłÌÍŒ(ÆäËüÊÔŒÁŚÔŃĄ)ĄŁ________________________________ĄŁ
·ÏßÁśłÌÍŒ(ÆäËüÊÔŒÁŚÔŃĄ)ĄŁ________________________________ĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÓëOH©ÓĐÏàÍŹ”çŚÓÊęșÍÖÊŚÓÊę”ÄÁŁŚÓÊÇŁš Ł©
A.F©
B.Cl©
C.NH3
D.H2O
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÏÂÁĐÓĐčŰË”·šÖĐŐęÈ·”ÄÊÇ
A. ÒÒÏ©”ÄœáččÍČÊœżÉÒÔ±íÊŸÎȘCH2CH2 B. ±œĄąÒÒŽŒșÍÒÒËᶌÄÜ·ąÉúÈĄŽú·ŽÓŠ
C. ÒÒŽŒșÍÒÒËᶌŽæÔÚÌŒŃőË«Œü D. Òș»ŻÊŻÓÍÆűșÍÌìÈ»Æű”ÄÖśÒȘłÉ·Ö¶ŒÊÇŒŚÍé
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÒŃÖȘ:25Ąæ,NH3Ą€H2O”çÀëÆœșⳣÊęKŁœ1.76ĄÁ10Ł5ĄŁ25Ąæ,Ïò1 L 0.1 mol/LÄłÒ»ÔȘËáHRÈÜÒșÖĐÖđœ„ÍšÈë°±ÆűŁŹÈôÈÜÒșζÈșÍÌć»ę±ŁłÖČ»±äŁŹËù”Ă»ìșÏÈÜÒș”ÄpHÓë![]() ±ä»Ż”ÄčŰÏ”ÈçÍŒËùÊŸĄŁÏÂÁĐĐđÊöŐęÈ·”ÄÊÇ
±ä»Ż”ÄčŰÏ”ÈçÍŒËùÊŸĄŁÏÂÁĐĐđÊöŐęÈ·”ÄÊÇ
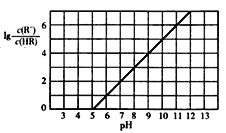
A. ÓÉÍŒżÉÍÆÖȘŁș25Ąæ,0.1 mol/L NaRÈÜÒș”ÄpHÔŒÎȘ10
B. ”±ÍšÈë0.1 mol NH3ʱŁŹËù”ĂÈÜÒșÖĐŁșc(NH4+)ŁŸc(RŁ)ŁŸc(OHŁ)ŁŸc(H+)
C. pHŁœ7ʱŁŹËù”ĂÈÜÒșÖĐŁșc(HR)ŁŸc(RŁ) =c(NH4+)
D. pHŁœ10ʱŁŹËù”ĂÈÜÒșÖĐŁșc(RŁ)ŁŸc(HR) ŁŹc(NH4+)ŁŸc(NH3Ą€H2O)
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżXĄąYĄąZĄąWÎȘ°ŽÔŚÓĐòÊęÓÉĐĄ”œŽóĆĆÁĐ”ÄËÄÖÖ¶ÌÖÜÆÚÔȘËŰŁŹÒŃÖȘŁș
ąÙXÔȘËŰÔŚÓŒÛ”çŚÓĆĆČŒÊœÎȘns2np2 ŁŹ ÇÒÔŚÓ°ëŸ¶ÊÇÍŹŚćÔȘËŰÖĐŚîĐĄ”ÄŁź
ąÚYÔȘËŰÊǔۿÇÖĐșŹÁżŚî¶à”ÄÔȘËŰŁ»WÔȘË۔ĔçžșĐÔÂÔĐĄÓÚYÔȘËŰŁŹÔÚWԌӔĔçŚÓĆĆČŒÖĐŁŹpčì”ÀÉÏÖ»ÓĐ1žöÎŽłÉ¶Ô”çŚÓŁź
ąÛZÔȘË۔ĔçÀëÄÜÊęŸĘŒû±íŁškJ/molŁ©Łș
I1 | I2 | I3 | I4 | Ą |
496 | 4562 | 6912 | 9540 | Ą |
Çë»ŰŽđŁș
Łš1Ł©Z2Y2”Ä”çŚÓÊœÎȘ ŁŹ șŹÓДĻŻŃ§ŒüÀàĐÍ ŁŹ Z2Y2ÎȘŸ§Ì棟
Łš2Ł©XĄąYĄąZÈęÖÖÔȘËŰËùĐγɔijŁŒû»ŻșÏÎï”ÄĂûłÆÎȘŁ»XY2”ÄœáččÊœÎȘ ŁŹ ·ÖŚÓÁąÌćččĐÍÎȘ Łź
Łš3Ł©XĄąYĄąZĄąWËÄÖÖÔȘËŰËùĐγɔĔ„ÖÊÖĐŁŹÈÛ”ăŚîžßĄąÓČ¶ÈŚîŽó”ÄÊÇŁšÌîĂûłÆŁ©Ł»Ÿ§ÌćZW”ÄÈÛ”ă±ÈŸ§ÌćXW4ĂśÏÔžß”ÄÔÒòÊÇ Łź
Č鿎Žđ°žșÍœâÎö>>
°Ù¶ÈÖÂĐĆ - Á·Ï°ČáÁбí - ÊÔÌâÁбí
șț±±ÊĄ»„ÁȘÍű΄·šșÍČ»ÁŒĐĆÏąŸÙ±šÆœÌš | ÍűÉÏÓĐșŠĐĆÏąŸÙ±šŚšÇű | ”çĐĆŐ©ÆŸÙ±šŚšÇű | ÉæÀúÊ·ĐéÎȚÖśÒćÓĐșŠĐĆÏąŸÙ±šŚšÇű | ÉæÆóÇÖÈšŸÙ±šŚšÇű
΄·šșÍČ»ÁŒĐĆÏąŸÙ±š”ç»°Łș027-86699610 ŸÙ±šÓÊÏäŁș58377363@163.com