
【题目】下列说法正确的是( )
A. 按系统命名法,化合物![]() 的名称为2-2-二甲基己烷
的名称为2-2-二甲基己烷
B. 等质量的聚乙烯、甲烷、乙炔分别充分燃烧,所耗氧气的量依次减少
C. 用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
D. 蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】
Ⅰ. 1)请对下列有机物进行分类,把正确答案(编号)填写在表格对应类别中
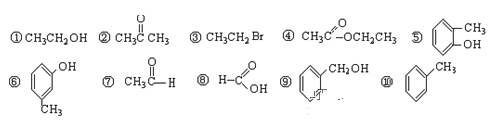
芳香烃 | 卤代烃 | 醇 | 酚 | 醛 | 酮 | 羧酸 | 酯 |
______ | ______ | ______ | ______ | ______ | ______ | ______ | ______ |
2)上述10种物质中,互为位置异构体的是(填写编号)______________________。
Ⅱ.用系统命名法写出下列烃的名称:
1)(CH3)2CHCH=CHCH(C2H5)CH2CH3 ______________________
2)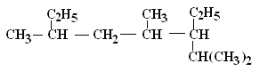 ______________________
______________________
Ⅲ. 物质A的系统命名为“1-丁烯”,其结构简式为____,请写出与该化合物含有相同官能团的所有其他同分异构体的结构简式及对应名称。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以钛白酸废液(主要含有TiO2+、Fe2+、Ca2+、SO![]() 等)为原料,获取磷酸钛(2TiO2·P2O5·H2O)和氧化铁黄(FeOOH)的部分流程如图:
等)为原料,获取磷酸钛(2TiO2·P2O5·H2O)和氧化铁黄(FeOOH)的部分流程如图:
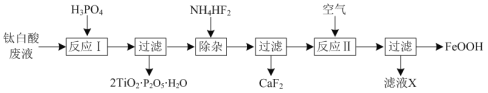
(1)反应Ⅰ中生成2TiO2·P2O5·H2O的离子方程式为___。
(2)反应Ⅱ时溶液的pH约为4,写出反应Ⅱ中Fe2+发生反应的离子方程式:___。
(3)碱性条件下,FeOOH可以被次氯酸钠氧化成Na2FeO4。该反应的离子方程式为___。
(4)TiO2是两性氧化物,TiO2与KHSO4熔融时反应生成TiOSO4的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型钴基电催化剂作用下,用石墨、铁做电极材料,可将CO2和水转化为甲酸。其反应原理如图所示,下列说法不正确的是( )

A.电极a为铁,与电源的负极相连
B.反应时化学能转化成电能
C.电极a上发生的反应为:CO2+2e-+2H2O=HCOOH+O2-
D.反应时,O2-向阳极处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: ____________________。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:______________________
![]() Ce3++
Ce3++![]() H2O2+
H2O2+![]() H2O===
H2O===![]() Ce(OH)4↓+
Ce(OH)4↓+![]() ________
________
(3)As可以与NaClO的水溶液反应,生成其最高价含氧酸(H3AsO4),写出该反应的化学方程式 : _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组进行如下实验,探究化学反应中的能量变化。
实验① | 实验② |
|
|
温度计读数升高 | 温度计读数降低 |
下列判断一定正确的是( )
A.实验①的反应中化学键断裂吸收的能量大于实验②
B.实验①的反应中化学键断裂吸收的能量小于实验②的反应中化学键形成放出的能量
C.实验①说明中和反应放出热量
D.实验②说明所有有氨气生成的反应均吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
________NaBiO3+________Mn2++________________![]() ________Na++________Bi3++_______________+______________。
________Na++________Bi3++_______________+______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=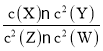 ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大X(g)浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com