
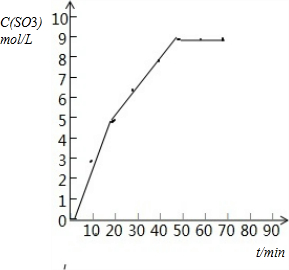
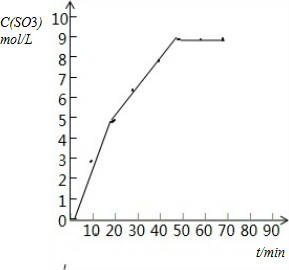
��1���±�Ϊij�¶Ⱥ�ѹǿ�£��ܱ�������SO2����ΪSO3��Ӧ�ڲ�ͬʱ������ʵ�Ũ�ȣ�mol/L��
| ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
�Ի���V��SO3��-tͼ��
��2����ҵ����������ʱ�����ô�������Ӧ��SO2ת��ΪSO3��һ���ؼ����裮ѹǿ���¶ȶ�SO2ת���ʵ�Ӱ�����±���ԭ�������ɷֵ��������Ϊ��SO2��7%��O2��11%��N2��82%����
| ѹǿ/MPa �¶�/�� | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
��������ñ��������ƶ�SO2��������Ӧ����ЧӦ��______��
����400һ500��ʱ��SO2�Ĵ��������ó�ѹ�����Ǹ�ѹ����Ҫԭ���ǣ�______��
�۹�ҵ��������������β������SO2������SO3��������Ϊ�˱���������β��ͨ�백ˮ�У��ܷ��������Ӧ��д�����п��ܷ���������������ԭ��Ӧ�Ļ�ѧ����ʽ��______��
�������ڲⶨ����β����SO2��������______��������ĸ��
A��NaOH��Һ����̪��Һ��
B��KMnO4��Һ��ϡH2SO4
C����ˮ��������Һ��������
D����ˮ����̪��Һ
��ij�¶��£�SO2����ΪSO3��10L���ܱ������н��У���ʼ����������4.0mol SO2��10.0mo1O2������Ӧ�ﵽƽ��ʱ���������Ϊ13.0mol����SO2��ת����Ϊ______�����¶ȷ�Ӧ��ƽ�ⳣ��______��
 ��
�� 2SO3
2SO3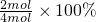 =50%��k=
=50%��k=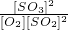 =
=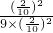 =1.1L?mol-1
=1.1L?mol-1


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| T/K | T1 | 573 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
| 1 |
| 7 |
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| ѹǿ/MPa �¶�/�� |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������һģ ���ͣ��ʴ���
| ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| ѹǿ/MPa �¶�/�� |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009��㶫ʡ�����и߿���ѧһģ�Ծ��������棩 ���ͣ������
| ʱ�䣨min�� | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |

| ѹǿ/MPa �¶�/�� | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com