【答案】
分析:A、B、C、D、E、F属于短周期主族元素.A的原子半径在短周期中最大,则A为钠元素;B的一种原子中,质量数与质子数之差为零,则该原子无中子,则B为氢元素;C元素的原子L层电子数是K层的2倍,则C为碳元素;C与D同主族,则D为硅元素;E原子的核外电子总数等于C、D原子核外电子总数的差,则E核外电子总数为8,故E为氧元素;E与F同主族,则F为硫元素.
解答:解:A、B、C、D、E、F属于短周期主族元素.A的原子半径在短周期中最大,则A为钠元素;B的一种原子中,质量数与质子数之差为零,则该原子无中子,则B为氢元素;C元素的原子L层电子数是K层的2倍,则C为碳元素;C与D同主族,则D为硅元素;E原子的核外电子总数等于C、D原子核外电子总数的差,则E核外电子总数为8,故E为氧元素;E与F同主族,则F为硫元素.故A为钠元素;B为氢元素;C为碳元素;D为硅元素;E为氧元素;F为硫元素.
(1)离子B
-为H
-,有1个电子层,核外有2个电子,结构示意图为
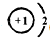
;化合物CE
2是CO
2,是直线对称分子属于非极性分子;A
2F是Na
2S,用电子式表示Na
2S的形成过程为
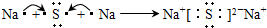
,
故答案为:
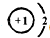
;非极性;
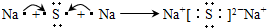
;
(2)A、E、F形成的简单离子分别为Na
+、O
2-、S
2-,电子层结构相同,核电荷数越大离子半径越小,所以离子半径Na
+<O
2-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径O
2-<S
2-,故离子半径S
2->O
2->Na
+;C为碳元素;D为硅元素;E为氧元素;元素C、D、E形成的常见单质中碳碳键键长比硅硅键键长短,所以熔沸点金刚石(石墨)>晶体硅,氧气为分子晶体,通常为气态,熔沸点最低,所以熔沸点金刚石(石墨)>晶体硅>氧气,
故答案为:S
2->O
2->Na
+;金刚石(石墨)>晶体硅>氧气;
(3)由B、C可以构成的最简单的化合物W为CH
4,16.0g分子式为CH
4?8H
2O的化合物的物质的量为
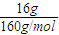
=0.1mol,释放的CH
4为0.1mol完全燃烧生成液态水,可放出89.03kJ的热量,则CH
4燃烧的热化学方程式为CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(l);△H=-890kJ?mol
-1,
故答案为:CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(l);△H=-890kJ?mol
-1;
(4)一个电极通入富含氧气单质的气体和少量CO
2,另一电极通入液化石油气(以C
4H
10表示),电池的电解质是熔融的K
2CO
3.燃料电池的总反应和燃料燃烧的化学方程式一致,电池总反应为2C
4H
10+13O
2═8CO
2+10H
2O,正极发生还原反应,氧气在正极放电,电极反应式为O
2+4e
-=2O
2-;负极发生氧化反应,在负极放电,总反应减正极反应可得负极极反应式,所以该电池的负极反应式为C
4H
10+13O
2--26e
-=4CO
2+5H
2O;原电池工作时,阴离子向负极移动,电子从负极经外电路流向正极电池工作时,电解质里的CO
32-向负极移动.
故答案为:C
4H
10+13O
2--26e
-=4CO
2+5H
2O;负.
点评:本题考查结构与位置关系、电子式、热化学方程式、原电池等,是对所学知识的综合运用与学生能力的考查,注意基础知识的掌握与理解,难度中等.(4)中电极反应式的书写为易错点、难点,利用两极反应式之和为总反应式进行书写,容易理解.

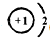 ;化合物CE2是CO2,是直线对称分子属于非极性分子;A2F是Na2S,用电子式表示Na2S的形成过程为
;化合物CE2是CO2,是直线对称分子属于非极性分子;A2F是Na2S,用电子式表示Na2S的形成过程为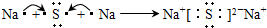 ,
,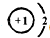 ;非极性;
;非极性;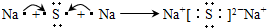 ;
;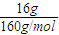 =0.1mol,释放的CH4为0.1mol完全燃烧生成液态水,可放出89.03kJ的热量,则CH4燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1,
=0.1mol,释放的CH4为0.1mol完全燃烧生成液态水,可放出89.03kJ的热量,则CH4燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1,

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.