
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答: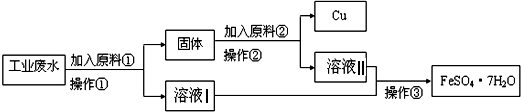
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
【答案】
(1)Fe+Cu2+=Fe2++Cu
(2)abc
(3)铁、铜
(4)稀硫酸;O2;Cu;
【解析】解:Ⅰ、(1)根据题意知,该物质能和铜离子反应且不引进新的杂质离子,所以物质为铁,铁与铜离子反应的离子方程式为:Cu2++Fe═Cu+Fe2+ ,
故答案为:Cu2++Fe═Cu+Fe2+;(2)操作②的分离是固体、液体分离,所以应用过滤的方法,故用到的玻璃仪器有:a.烧杯b.漏斗c.玻璃棒,故答案为:abc;(3)操作①中加入过量的铁才能使铜离子完全反应Cu2++Fe═Cu+Fe2+ , 所以所得固体的成分是铁和铜,故答案为:铁、铜;(4)操作①中加入过量的铁才能使铜离子完全反应,所以所得固体的成分是铁和铜,分离铁和铜且回收铜,所以加入某物质与铁反应,与铜不反应,且与铁反应后的物质与操作①所得溶液中溶质的成分一样,加入的物质为稀硫酸,故答案为:稀硫酸;Ⅱ、①2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,O2得电子化合价降低(0→﹣2)是氧化剂,Cu失电子化合价升高(0→+2)是还原剂,故答案为:O2;Cu;②2Cu+2H2SO4+O2
2CuSO4+2H2O反应中,O2得电子化合价降低(0→﹣2)是氧化剂,Cu失电子化合价升高(0→+2)是还原剂,故答案为:O2;Cu;②2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中氧气为氧化剂,O元素的化合价0→﹣2,铜为还原剂,Cu元素的化合价0→+2,转移电子数为:4e﹣ , 用双线桥表示为:
2CuSO4+2H2O反应中氧气为氧化剂,O元素的化合价0→﹣2,铜为还原剂,Cu元素的化合价0→+2,转移电子数为:4e﹣ , 用双线桥表示为:  ,故答案为:
,故答案为:  .
.
Ⅰ、(1)根据该题要求:回收铜且不引进新的杂质判断原料①,并写出反应的离子方程式;(2)根据混合物的状态确定实验操作,根据实验操作确定实验仪器;(3)固体成份是过量的铁和置换出的铜;(4)先判断操作①后的固体成分,再根据流程图知:操作①后的溶液中的溶质与操作②后的溶液中的溶质相同判断原料②;Ⅱ、①在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;②反应中氧气为氧化剂,铜为还原剂,根据O元素的化合价0→﹣2,和Cu元素的化合价0→+2,标出电子的转移方向和数目.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
A.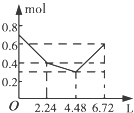
B.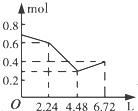
C.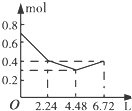
D.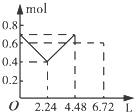
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,并利用下列装置制取碳酸氢钠粗品,实验装置正确且能达到实验目的是( )
A.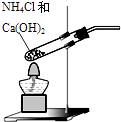
用装置制取氨气
B.
用装置制取二氧化碳
C.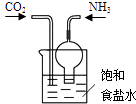
用装置制取碳酸氢钠
D.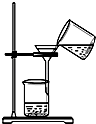
用装置分离碳酸氢钠与母液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( ) 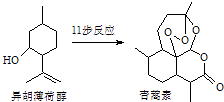
A.异胡薄荷醇的分子式为C10H17O
B.异胡薄荷醇在NaOH醇溶液中可发生消去反应
C.青蒿素分子中含有7个手性碳原子
D.青蒿素在热的酸、碱溶液中均可稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质发生反应时,生成物不因反应条件(浓度、温度或催化剂等)的不同而不同的是
A. 铜与硝酸B. 乙醇与氧气
C. 钠与氧气D. 一氧化碳与氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中常要控制化学反应条件增大反应速率.下列措施中不能加快化学反应速率的是( )
A.尽可能使用稀溶液
B.选择合适的催化剂
C.碾细固体反应物
D.提高反应体系的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com