
����Ŀ����SO2�ֱ�ͨ������4����Һ�У���ش�����������
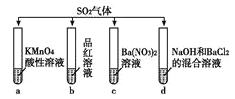
��1���Թ�a������Һ��ɫ������˵��SO2����________�ԣ��Թ�b������Һ��ɫ������˵��SO2����________�ԡ�
��2���Թ�d���ְ�ɫ�������ó����ܹ��ܽ���ϡ�����У�д�����ɸó��������ӷ���ʽ��________________��
��3��������Թ�d�е�NaOH����ΪBr2��BaCl2�Ļ����Һ�����Եõ�һ��������ǿ��İ�ɫ������д���ù����з���������ԭ��Ӧ�����ӷ���ʽ��________��
��4���Թ�c��Ҳ�ɵõ�������ǿ��İ�ɫ��������������ó���������ԭ����________��
���𰸡� ��ԭ Ư�� SO2+2OH-+Ba2+=BaSO3��+H2O ![]()
![]() ����Һ�����ԣ�������������
����Һ�����ԣ�������������![]() ����+4����Ԫ������
����+4����Ԫ������![]() ��
�� ![]() ���Ba2+����BaSO4����
���Ba2+����BaSO4����
����������1���Թ�a������Һ��ɫ����������ر���ԭ��˵��SO2���л�ԭ�ԣ��Թ�b������Һ��ɫ������˵��SO2����Ư���ԡ���2���Թ�d���ְ�ɫ�������ó����ܹ��ܽ���ϡ�����У�˵���������ᱵ��������ɸó��������ӷ���ʽΪSO2+2OH-+Ba2+=BaSO3��+H2O����3��������Թ�d�е�NaOH����ΪBr2��BaCl2�Ļ����Һ�����Եõ�һ��������ǿ��İ�ɫ�������������ڶ�������������Ϊ���ᣬ�����������ᱵ�������ù����з���������ԭ��Ӧ�����ӷ���ʽΪBr2��SO2��2H2O��4H����2Br����SO42������4��������������ˮ��SO2��H2O![]() H2SO3����Һ�����ԣ��������������������+4����Ԫ����������SO42����SO42�����Ba2+����BaSO4������
H2SO3����Һ�����ԣ��������������������+4����Ԫ����������SO42����SO42�����Ba2+����BaSO4������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��BΪ���ʣ�CΪ�����A+B![]() C
C![]()
![]() A+B����ʵ������ת����ϵ���ǣ�������
A+B����ʵ������ת����ϵ���ǣ�������
����C����ˮ��õ�ǿ����Һ����A������Na
����C����Һ��Na2CO3 �� �ų�CO2���壬��A������H2
����C����Һ�еμ�KSCN��Һ�Ժ�ɫ����B����ΪFe
����C����Һ�еμ�NaOH��Һ����ɫ�������ɣ���B����ΪCu��
A.�٢�
B.�ڢ�
C.�٢�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ī�����к���һ����̼������X��ʵ���Ҳⶨ������X�����ʵ������������˵������ȷ����

A. ����2��������
B. X����������Ũ���ᷴӦ������NO2��CO2����
C. ��Һ���п��ܺ���Fe3+
D. X�Ļ�ѧʽ���Ա�ʾΪFe3C2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]��
��1�������д��������£�CH3OH��O2��Ӧ��Ҫ�������CO��CO2����HCHO������2HCHO��g��+O2��g���T2CO��g��+2H2O��g����H= ��
�ڼ״���ȡ��ȩ����Ag������������AgCl��Ӱ��Ag�����Ļ��ԣ��ð�ˮ�����ܽ��ȥ���е�AgCl��д���÷�Ӧ�����ӷ���ʽ�� ��
��2����֪��CO��g��+2H2��g��CH3OH��g����H=��a kJmol��1 ��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc��CO��=0.4molL��1��c��H2��=0.4molL��1��c��CH3OH��=0.8molL��1 �� ���ʱv��v�������������������=������
��ij�¶��£�������̶���2L���ܱ������н�1mol CO��2mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ�ȣ�P��/Pǰ�� | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
��0��15min����H2��ʾ��ƽ����Ӧ����Ϊ �� �ﵽƽ��ʱCO��ת����Ϊ ��
��3�������Ƽ�ѭ�����ɳ�ȥSO2 �� ����SO2�Ի�������Ⱦ������Һ����SO2�Ĺ����У�pH��n��SO32������n��HSO3�����仯��ϵ���±���
n��SO32������n��HSO3���� | 91��9 | 1��1 | 1��91 |
pH | 8.2 | 7.2 | 6.2 |
�ٸ����ϱ��ж�NaHSO3��Һ���ԣ�
����NaHSO3��Һ������Ũ�ȹ�ϵ��ȷ���� ������ĸ����
a��c��Na+��=2c��SO32����+c��HSO3����
b��c��Na+����c��HSO3������c��H+����c��SO32������c��OH����
c��c��H2SO3��+c��H+��=c��SO32����+��OH����
d��c��Na+��+c��H+��=c��SO32����+c��HSO3����+c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijˮ��Һ�д�������H+��Mg2+��K+��NO3����Cl���е��������ӣ��Ҵ��ڵĸ����Ӿ�����ͬ�����ʵ��������ܴ��ڵ������ǣ�������
A.H+
B.Mg2+
C.Cl��
D.NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������á��������� ![]() Pu��Ϊ��Դ���ϣ����й���
Pu��Ϊ��Դ���ϣ����й��� ![]() Pu��˵����ȷ���ǣ� ��
Pu��˵����ȷ���ǣ� ��
A.![]() Pu��
Pu�� ![]() U��Ϊͬλ��
U��Ϊͬλ��
B.![]() Pu��
Pu�� ![]() Pu��Ϊͬ��������
Pu��Ϊͬ��������
C.![]() Pu��
Pu�� ![]() U������ȫ��ͬ�Ļ�ѧ����
U������ȫ��ͬ�Ļ�ѧ����
D.![]() Pu��
Pu�� ![]() Pu������ͬ������������
Pu������ͬ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ����з������з�ӦaA��g��cC��g��+dD��g����ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ���ǣ�������
A.A��ת���ʱ��
B.ƽ��������Ӧ�����ƶ�
C.D������������
D.a��c+d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú����CO ��H2������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�
C ��s��+H2O��g��CO��g��+H2 ��g����H=+131.3kJmol��1
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�������/��С/���䣩��
��2��������Ӧ�ﵽƽ�����ϵ�е�C��s��ȫ�����ߣ�ƽ����������/������/���ƶ�����
��3��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬����������ţ���
A.��λ�����ÿ����1mol CO��ͬʱ����1molH2
B.������������ʵ������ֲ���
C.����H2O��g��������������CO���������
D.H2O��g����CO��H2��Ũ�����
��4��ij�¶��£���4.0mol H2O��g����������̿����2L���ܱ������У��������·�Ӧ��C��s��+H2O��g��CO ��g��+H2 ��g�����ﵽƽ��ʱ���K=1������¶���H2O��g����ת����Ϊ
��5����֪����C ��s��+H2O��l��CO ��g��+H2 ��g����H1
��2CO��g��+O2��g���T2CO2��g����H 2
��H2O��l���TH2��g��+ ![]() O2��g����H 3
O2��g����H 3
��2C��s��+2O2��g���T2CO2��g���ġ�H= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ��������ᶼ����Ҫ�Ļ���ԭ�ϣ�Ҳ�ǻ�ѧʵ������ر�����Ҫ�Լ�����ش����и��ʣ�
��1�������£������������Ƶ�����ʢ��Ũ���ᣬ˵��Ũ������� ��.
��2������ͭ���Ʊ�Cu-Zn-Alϵ��������Ҫԭ�ϣ���ҵ����ϴ���ķ�ͭм��ԭ�����Ʊ�����ͭ�������Ʊ�������������ɫ��ѧ��˼����� ������ţ���
�� Cu + HNO3��Ũ���� Cu(NO3)2
�� Cu + HNO3��ϡ���� Cu(NO3)2
�� Cu![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
��3������50mL 18mol��L-1��Ũ�����м��������ͭƬ������ʹ֮��ַ�Ӧ�������������ڱ�״���µ���������� ��
A��20.16L B��6.72L C��10.08L D��15.12L
����ʹ������Ӧ����ʣ���ͭƬ�����ܽ⣬�������м��������ƣ�д����Ӧ�����ӷ���ʽ ��
��4��ijͬѧ�����ͭƬ��ϡ�����м���H2O2��ͭƬ�ܽ⣬���Ҹ÷�Ӧ�IJ���ֻ���Ȼ�ͭ��ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com