
| A.高碘酸和碘酸都是强酸 |
| B.高碘酸和碘酸都是弱酸 |
| C.高碘酸是弱酸、碘酸是强酸 |
| D.高碘酸是强酸、碘酸是弱酸 |
科目:高中化学 来源:不详 题型:填空题
 和
和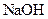 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的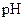 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):| 实验编号 |  物质的量浓度 物质的量浓度( 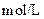 ) ) | 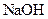 物质的量浓度 物质的量浓度( 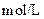 ) ) | 混合溶液的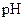 |
| 甲 | 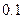 | 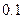 | 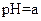 |
| 乙 | 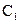 | 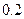 | 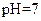 |
| 丙 | 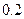 | 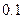 | 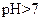 |
| 丁 | 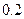 | 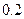 | 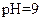 |
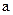 的取值范围为 。
的取值范围为 。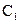 是否一定等于
是否一定等于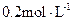 (选填“是”或“否”)。若
(选填“是”或“否”)。若 为弱酸,计算出该混合溶液达平衡时
为弱酸,计算出该混合溶液达平衡时 电离常数
电离常数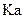 的近似值是 (用含
的近似值是 (用含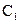 代数式表示)。
代数式表示)。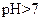 的原因是 ,该组混合溶液中离子浓度的大小关系是 。
的原因是 ,该组混合溶液中离子浓度的大小关系是 。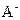 在该条件下的水解度是 ,该溶液中,水电离出的
在该条件下的水解度是 ,该溶液中,水电离出的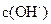 是
是 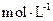 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
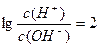 .有关反应后该混合溶液的叙述正确的是
.有关反应后该混合溶液的叙述正确的是| A.上述反应对应的离子方程式为2ClO-+CO2+H2O=2HClO+CO32- |
| B.上述溶液中:c(ClO-)>c(HCO3-)>c(CO32-) |
| C.上述溶液中:c(ClO-)+c(HClO)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.上述溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(HCN)+c(CN-)=c(Na+) |
| B.c(HCN)+2c(H+)=2c(OH-)+c(CN-) |
| C.c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+) |
| D.c(HCN)>c(CN-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH =0的无色溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B.使甲基橙变红的溶液中:Na+、HCO3-、Cl-、NO3- |
| C.在有大量MnO4-溶液中:K+、Fe2+、SO42-、Cl- |
| D.投入Al有氢所放出的溶液中:Na+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
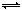 H++ln—,已知在pH<3.1的溶液中呈红色,在pH>4.4的溶液中呈黄色,下列判断中不正确的是 ( )
H++ln—,已知在pH<3.1的溶液中呈红色,在pH>4.4的溶液中呈黄色,下列判断中不正确的是 ( )| A.Hln呈红色 |
B.ln—呈黄色 |
| C.遇pH值介于3.1~4.4的溶液可能呈橙色 |
| D.Hln呈黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.某强酸性溶液:Na+、Fe2+、Cl-、ClO- |
| B.加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、CO32- |
C.常温下pH=14的溶液:Al3+、Na+、Cl-、HCO3- |
D.常温下c(OH-)/c(H+)=1012的溶液:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com