
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
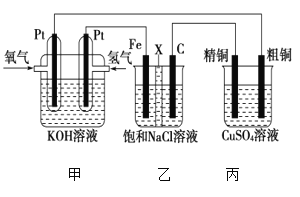
①石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。乙池中电解总方程式为____________。
②如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为______________________。
③若在标准状况下,有224 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为________mL;丙装置中阴极析出铜的质量为________g。
【答案】2CO(g)+O2(g)= 2CO2(g) ΔH=-566 kJ/mol 阳极 铁极 2NaCl+2H2O![]() 2NaOH+H2+Cl2 减小 Cu2++2e-=Cu 448 1.28
2NaOH+H2+Cl2 减小 Cu2++2e-=Cu 448 1.28
【解析】
I.根据盖斯定律求解;
Ⅱ.根据图像可知,甲为氢氧碱性燃料电池,通入氢气的一极为负极,通入氧气的一极为正极;则乙、丙为电解池,粗铜、C与电源的正极相连为阳极,Fe、精铜为阴极。
Ⅰ.根据盖斯定律,(③-②)/2+①即可得到,CO(g)+![]() O2(g)=CO2(g)
O2(g)=CO2(g)![]() -393.5=-283kJ/mol;
-393.5=-283kJ/mol;
Ⅱ. ①分析可知,C为阳极;溶液中的氯离子失电子生成氯气,Fe电极水得电子生成氢气和氢氧根离子,则铁极区先变红,总反应式为2NaCl+2H2O![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() ;
;
②粗铜电极反应式:Cu-2e-=Cu2+,Zn-2e-=Zn2+,阴极(精铜):Cu2++2e-=Cu,则溶液中的铜离子浓度减小;
③标准状况下,224 mL氧气,即0.01mol,化合价由0变为-2,转移0.04mol电子,则铁电极生成0.02mol氢气,即标况下为448mL;丙装置生成0.02molCu,即1.28g。


科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为________(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________mol·L-1。
(3)为减少SO2的排放,可用某些溶液洗涤含SO2的烟气。以下物质可做洗涤剂的是__________________________(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_____________________________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:

已知:I.“氯化浸出”过程中,需分批多次加入NaC1O3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有________________(任写一条);加入过量盐酸的主要目的是______________________.
(2)浸出渣中含有S和____________(写化学式);浸出液中所含的金属阳离子有Na+、Bi3+及___________________.
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式__________________________.
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及____________。
(5)“电解”过程的简易装置如图所示。装置中N为电源的______________(填“正”或“负”)极;阳极上发生的主要电极反应式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸和铜在加热时反应,生成SO2气体的体积为3.36L(标准状况下)。已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
(1)SO2气体的物质的量是多少?___
(2)参加反应的硫酸的物质的量是多少?___
(3)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:C(金刚石,s)+O2(g)=CO2(g) △H1 ;
C(石墨,s)+O2(g)=CO2(g) △H2;
C(石墨,s)=C(金刚石,s)△H3=+1.9kJ/mol 下列说法正确的是
A. 金刚石比石墨稳定 B. △H1 > △H2
C. △H3=△H1 -△H2 D. 石墨转化成金刚石的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究物质的性质和用途,需要对物质进行分离与提纯。根据下列信息回答问题。
(1)要从氯化钠和纯碱的混合物中分离出纯碱晶体可采取的方法是_______(填代号)
a.溶解,过滤 b. 溶解,蒸发结晶,过滤 c. 溶解,蒸发浓缩,降温结晶

(2)某同学设计的分离CO2和CO混合气体的实验。装置如图所示:

关闭b,打开a,混合气体通过该装置时,先得到的气体是_________,然后进行的操作是________________________,得到的气体是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)X的值等于__________;
(2)A的转化率为_________________。
(3)生成D的反应速率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:

②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___(任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是___(填化学式)。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是___。
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为___,若加A后将溶液的pH调为5,则溶液中Fe3+的浓度为___ mol/L。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___。
(5)“赶氨”时,最适宜的操作方法是___。
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___(保留到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com