
| A. | 10 mL18.4mol•L-1浓硫酸与足量锌反应,转移电子数为0.184NA | |
| B. | 0.1 mol24Mg18O晶体中所含中子总数为2.0 NA | |
| C. | 在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA |
分析 A.浓硫酸与足量锌反应,开始生成二氧化硫气体,浓硫酸变稀和锌反应生成氢气,结合氧化还原反应电子转移计算分析;
B.质量数=质子数+中子数;
C.氮气分子和一氧化碳分子是等电子体,且分子量相同,所以可以把混合物当作一种物质进行计算,根据气体的物质的量和分子的构成计算电子数;
D.NaClO溶液中次氯酸根离子水解减小;
解答 解:A.浓硫酸与足量锌反应,开始生成二氧化硫气体,1mol硫酸被还原生成1mol二氧化硫,电子转移2mol,浓硫酸变稀和锌反应生成氢气,稀硫酸反应1mol反应生成1mol氢气单质转移2mol,则10 mL18.4mol•L-1浓硫酸物质的量=0.010L×18.4mol•L-1=0.184mol,电子转移0.184mol×2×NA=0.368NA,故A错误;
B.0.1 mol24Mg18O晶体中所含中子总数=0.1mol×(24-12+18-8)×NA=2.2NA,故B错误;
C.一个氮气分子或一氧化碳分子中都含有14的电子,氮气和一氧化碳的摩尔质量相等,所以可把两种物质当成一种物质进行计算,2.8 g N2和2.8 g CO的物质的量都是0.1mol,含有的电子数都是1.4 NA,故C正确;
D.NaClO溶液中次氯酸根离子水解,1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目小于NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数,题目难度不大,注意氧化还原反应电子转移数的计算、盐类水解、气体摩尔体积计算条件等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
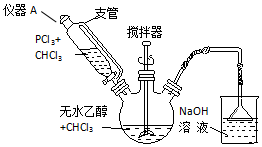
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
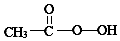 )常用作纺织品漂白剂.
)常用作纺织品漂白剂.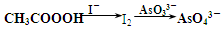
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体带电荷,溶液不带电荷 | |
| B. | 胶体区别于其它分散系的本质特征是分散质的直径大小 | |
| C. | 将一柬光线通过胶体时可出现一条光亮的通路,通过溶液则没有此现象 | |
| D. | 土壤胶粒的表面巨大且带负电,能吸附NH${\;}_{4}^{+}$等营养离子,使土壤具有保肥能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前后的气体质量之比一定是1:3 | |
| B. | 两种单质X、Y的摩尔质量之比是1:3 | |
| C. | 在生成物Z中,X的质量分数为50% | |
| D. | Z中X、Y两元素的原子个数比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50g | B. | 60mol/g | C. | 60g/mol | D. | 50g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:K+、Ba2+、NO3-、Cl- | |
| B. | 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | 中性溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com