
【题目】某温度下,在2 L的密闭容器中,加入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+mY(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为60%、30%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为60%、30%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=1B.第二次平衡时,Y的浓度为1.2 mol·L-1
C.两次平衡的平衡常数相同D.X与Y的平衡转化率相等
【答案】B
【解析】
A. 平衡时,X、Y、Z的体积分数分别为60%、30%、10%,在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变,加入1mol Z(g)相当于增大压强,各物质的体积分数不变,说明加压平衡不移动,说明该反应前后气体计量数之和不变,所以m=1,A项正确;
B. 该反应2X(g)+Y(g)![]() 3Z(g)前后气体计量数之和不变,加入2 mol X(g)和1 mol Y(g),平衡时,X、Y、Z的体积分数分别为60%、30%、10%,则Y的物质的量为3mol×30%=0.9mol,则
3Z(g)前后气体计量数之和不变,加入2 mol X(g)和1 mol Y(g),平衡时,X、Y、Z的体积分数分别为60%、30%、10%,则Y的物质的量为3mol×30%=0.9mol,则![]() ,由极限转化可知,开始加入2 mol X(g)和1 mol Y(g)相当于开始投入3molZ,体积不变,再加入1mol Z,新平衡相当于加入了4mol Z,则
,由极限转化可知,开始加入2 mol X(g)和1 mol Y(g)相当于开始投入3molZ,体积不变,再加入1mol Z,新平衡相当于加入了4mol Z,则![]() ,解得c(Y)第二次=0.6mol/L,B项错误;
,解得c(Y)第二次=0.6mol/L,B项错误;
C. 平衡常数只与温度有关,温度不变,平衡常数不变,所以两次平衡的平衡常数相同,C项正确;
D. X、Y的起始物质的量之比为2:1,二者按物质的量2:1反应,故二者转化率相等,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】在2A+3B![]() C+4D反应中,表示该反应速率最快的是( )
C+4D反应中,表示该反应速率最快的是( )
A.υ(A)=0.5mol/(L·s)B.υ(B)=0.8mol/(L·s)
C.υ(C)=0.3mol/(L·s)D.υ(D)=10mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②![]()
![]() ,
,
③![]()
![]()
则表示氢气燃烧热的热化学方程式为________。
(2)判断下列反应的熵值是增大、减小还是几乎不变。
①2H2(g)+O2(g)=2H2O(l);熵 ________(填“增大”“减小”“几乎不变”,下同)
②H2(g)+Cl2(g)=2HCl(g);熵________
③(NH4)2CO3(g)=NH4HCO3(g)+NH3(g);熵________
④Cu(s)+Cl2(g)=CuCl2(s);熵________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
①标准状况下,4.48L NO 和2.24L O2 充分混合后所得混合物分子数为0.2NA
②含13g甲醛(HCHO)和17g乙酸(CH3COOH)的液体混合物中,氧原子数目为NA
③0.1 mol H2和 0.1 mol I2于密闭容器中充分反应后,其分子总数为 0.2NA
④1mol Na2O 和Na2O2混合物中含有的阴、阳离子总数是3NA
⑤常温常压下,30g的C2H6含有的共价键数为6NA
⑥标准状况下,22.4L HF中所含F原子数目为NA
⑦在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
A.②③④⑦B.①④⑤⑥C.①②③⑤⑥D.①②④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的操作、现象和结论(或解释)均正确的是( )
操作 | 现象 | 结论(或解释) | |
A | 向某溶液中滴加Ba(NO3)2溶液和稀盐酸 | 生成白色沉淀 | 原溶液中有SO42- |
B | 密闭容器中有反应:A(g)+B(g) | 再次达到平衡时测得c(C)为0.8mol·L-1 | x=l,增大压强平衡正向移动 |
C | 往试管中加入2mL 10%的CuSO4溶液,再滴入4~6滴2%的NaOH溶液,振荡后加入2mL葡萄糖溶液,加热煮沸 | 产生砖红色沉淀 | 葡萄糖分子结构中有醛基 |
D | 向某溶液中滴加新制氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(![]() 和
和![]() ),其流程为:
),其流程为:
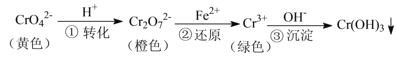
已知:步骤③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有关说法不正确的是
A.步骤①中当![]() 时,说明反应:
时,说明反应:![]() 达到平衡状态
达到平衡状态
B.若向![]() 溶液中加NaOH浓溶液,溶液可由橙色变黄色
溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原![]() 离子,需要
离子,需要![]()
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽![]() 当溶液中
当溶液中![]() 时,可视作该离子沉淀完全
时,可视作该离子沉淀完全![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线为 下列说法错误的是( )
下列说法错误的是( )
A.反应①为取代反应,反应条件为氯气、光照
B.![]() 水解的离子方程式为
水解的离子方程式为
C.反应②和反应④的反应条件均为NaOH的水溶液、加热
D.![]() 分子中所有碳原子一定在同一平面内
分子中所有碳原子一定在同一平面内
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com