
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
 2NH3
2NH3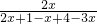 ×100%=15%
×100%=15%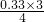 ×100%≈24.45%,故答案为:24.45%;
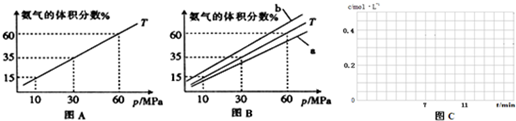
×100%≈24.45%,故答案为:24.45%; 2NH3,△H<0,当温度升高时,化学平衡向吸热热反应方向移动,即逆反应移动,所以氨气的体积分数减少,对应的曲线是a,
2NH3,△H<0,当温度升高时,化学平衡向吸热热反应方向移动,即逆反应移动,所以氨气的体积分数减少,对应的曲线是a, =
=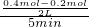 =0.02mol/L?min-1;
=0.02mol/L?min-1;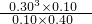 =0.0675,
=0.0675,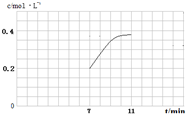 ,故答案为:
,故答案为: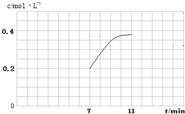 ;
; 来计算反应的速率;
来计算反应的速率;

科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有______种峰(即有几种化学环境完全相同H原子),错误的结构有______种峰.
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有______种峰(即有几种化学环境完全相同H原子),错误的结构有______种峰.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
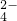 、NO
、NO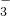
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 2Fe+3CO2
2Fe+3CO2 4NO+6H2O
4NO+6H2O 2Fe2O3+8SO3
2Fe2O3+8SO3查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com