
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |
分析 A.金属阳离子的电子层数比原子的电子层数少1;
B.从IIIB族到IIB族 10个纵行为过渡元素;
C.He的最外层电子数为2,其它稀有气体原子的最外层电子数都是8;
D.同位素的物理性质不同,化学性质相同.
解答 解:A.金属阳离子的电子层数比原子的电子层数少1,而原子的核外电子层数等于该元素所在的周期数,单核阴离子的核外电子层数等于该元素所在的周期数,故A错误;
B.从IIIB族到IIB族 10个纵行为过渡元素,均为金属元素,故B正确;
C.He的最外层电子数为2,其它稀有气体原子的最外层电子数都是8,均为稳定结构,故C正确;
D.同位素的电子排布相同,化学性质相同,而物理性质不同,故D错误;
故选AD.
点评 本题考查元素周期表的应用,为高频考点,把握原子结构、元素的位置为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
 人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的球棍模型: | |
| B. | COCl2的电子式: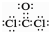 | |
| C. | 质子数为6、质量数为14的原子:${\;}_{6}^{14}$N | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4(熔融)→K++H++SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2,2,3,3-四甲基戊烷由烯烃加成而来,则该烯烃的名称是2,2,3,3-四甲基-1--戊烯 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁是人体健康、植树生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 | |
| B. | 在采煤作业中,把炸药和干冰放在一起,既能增强爆炸威力,又能防止火灾 | |
| C. | 氢氧燃料电池已用于航天飞机,燃料电池的能量转化率理论上可达100% | |
| D. | 聚乙烯塑料可用于制作餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 变成血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6],振荡 | 产生蓝色沉淀 | 存在Fe2+ |
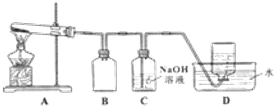
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硫酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com