
����Ŀ��t��ʱ����2mol����A��1mol����B�����ݻ�Ϊ2L�ĺ����ܱ������У��������·�Ӧ��2A��g��+B��g��xC��g����2minʱ��ѧ��Ӧ�ﵽ�ȣ��¶���Ϊt�棩����ʱB���� 0.6mol�������C��Ũ��Ϊ0.6molL��1 �� ��ش��������⣺
��1���жϸ÷�Ӧ�ﵽ�ȵı�־�� a�������е�ѹǿ���ֲ���
b��A������������B����������֮��Ϊ2��1
c�������ڻ��������ܶȱ��ֲ���
d��A�İٷֺ������ֲ���
e��B��C�����ʵ���Ũ��֮��Ϊ1��x
��2��x= �� �ӷ�Ӧ��ʼ���ﵽ��ʱ����B��ʾ�÷�Ӧ��ƽ����Ӧ����V��B��=��
��3���������¶Ȳ��䣬�������������������Ӧ���������������С�����䡱��
��4����ѧ��Ӧ�ﵽ��ʱ��A��ת����Ϊ ��
���𰸡�
��1��bd
��2��3��0.1mol?L��1?min��1
��3����С
��4��40%
���������⣺2minʱ��ѧ��Ӧ�ﵽ�ȣ��¶���Ϊt�棩����ʱB���� 0.6mol��ת����BΪ ![]() =0.2mol/L�������C��Ũ��Ϊ0.6molL��1 �� ��
=0.2mol/L�������C��Ũ��Ϊ0.6molL��1 �� �� ![]() �����x=3����
�����x=3����
2A��g��+ | B��g�� | 3C��g�� | |
��ʼ | 2 | 1 | 0 |
ת�� | 0.8 | 0.4 | 1.2 |
ƽ�� | 1.2 | 0.6 | 1.2 |
����1��a���÷�ӦΪ�����������ķ�Ӧ���������е�ѹǿ���ֲ��䣬�����ж�ƽ�⣬�ʲ�ѡ��
b��A������������B����������֮��Ϊ2��1��Ϊ��ͬ���ʵ����淴Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ��ﵽƽ��״̬����ѡ��
c��������������䣬�������ڻ��������ܶȱ��ֲ��䣬�����ж�ƽ�⣬�ʲ�ѡ��
d��A�İٷֺ������ֲ��䣬����������������Ϊƽ��״̬����ѡ��
e��������������֪��B��C�����ʵ���Ũ��֮��Ϊ1��2���ʲ�ѡ��
���Դ��ǣ�bd����2��������������֪��x=3����B��ʾ�÷�Ӧ��ƽ����Ӧ����V��B��= ![]() =0.1 molL��1min��1 ��
=0.1 molL��1min��1 ��
���Դ��ǣ�3��0.1 molL��1min��1����3�������¶Ȳ��䣬�������������ѹǿ��С������Ӧ���ʼ�С�����Դ��ǣ���С����4����ѧ��Ӧ�ﵽ��ʱ��A��ת����Ϊ ![]() ��100%=40%�����Դ��ǣ�40%��
��100%=40%�����Դ��ǣ�40%��
�����㾫�������ջ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�������������ᷢչ�Ļ������о���ѧ��Ӧ�е������仯�������ڸ��õ����û�ѧ��ӦΪ��������������Ķ������й���Դ�IJ��ϣ��ش��й����⣺ 
��1���������ĽǶȿ����ɼ����ѣ��¼��γɱ�Ȼ�������仯����֪��1molH��H����1mol I��I��1mol H��I���ֱ���Ҫ���յ�����Ϊ436kJ��151kJ��299kJ�����������͵ⷴӦ����1mol HI��Ҫ����ų��������ա���kJ��������
��2���������������о���������ѧ������ܵ��ת���� ����ͼ�ס�����װ���У����и����缫��ӦʽΪ �� ��Һ�е������������ƶ����Zn����Pt����������ͭ�缫������������Ӧ�����������ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦCH3OH(l)��NH3(g)===CH3NH2(g)��H2O(g)��ij�¶��Է����ҽ��У�����Ӧ��|��H|��17 kJ��mol��1��|��H��T��S|��17 kJ��mol��1����������ȷ��
A����H>0����H��T��S<0 B����H<0����H��T��S>0
C����H>0����H��T��S>0 D����H<0����H��T��S<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)�ﵽƽ���ı�����������SO3(g)ƽ��Ũ�Ȳ��ı����
2SO3(g)�ﵽƽ���ı�����������SO3(g)ƽ��Ũ�Ȳ��ı����
A. �����¶Ⱥ�����������䣬����1mol SO3(g)
B. �����¶Ⱥ�������ѹǿ���䣬����1molO2(g)
C. �����¶Ⱥ�������ѹǿ���䣬����1mol SO3(g)
D. �����¶Ⱥ�������ѹǿ���䣬����1mol Ar(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ϊ������Ԫ�أ�A��B��ͬ�������ڵ�����Ԫ�أ�A��C��ͬ�������ڵ�����Ԫ�أ�A��B��C����Ԫ�ص�ԭ������֮��Ϊ31��DԪ����A��B��C����Ԫ�ؼȲ�ͬ���ڣ�Ҳ��ͬ���壬��ش�
��1��CԪ����Ԫ�����ڱ��е�λ������
��2��A��B��D�����һ�����ӻ�����dz����Ļ��ʣ��仯ѧʽΪ��
��3��A2��D2�������ʿ��Թ���һ�����͵�ԭ��أ���ԭ����е������ҺΪKOH��Һ���������ĵ缫��ӦʽΪ��
��4������һ����20mLBA2��A2�������Ĵ��Թܵ�����D2A�У���ַ�Ӧ������ͬ�����£�����Թ�������5mL��ɫ���壬��ԭ���������BA2��A2���ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л��������ͨ�����Ϸ�Ӧһ���Ƶã�����ͨ�����ֽⷴӦһ���Ƶõ��ǣ� ��
A.SO3B.FeCl2C.CuD.H2SiO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��ijɷ���Cu2O����ͭ��ijɷ���Cu2S������ͭ�����ͭ���ϼ��������·�Ӧ��2Cu2O+Cu2S ![]() 6Cu+SO2�������ڸ÷�Ӧ������˵����ȷ������ ��
6Cu+SO2�������ڸ÷�Ӧ������˵����ȷ������ ��
A. �÷�Ӧ��������ֻ��Cu2O
B. Cu���������������ǻ�ԭ����
C. ÿ����1 mol Cu����ԭ��ת�Ƹ��������ĵ���Ϊ2 mol
D. �÷�Ӧ�����������뻹ԭ�����������Ϊ1��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(9��)����۲�����װ�ã��ش��������⣺
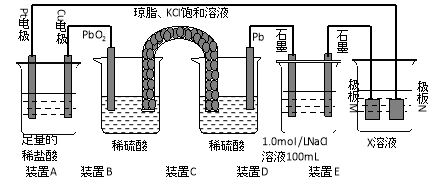
��װ��B��PbO2�Ϸ����ĵ缫��Ӧ����ʽΪ ��
��װ��A���ܷ�Ӧ�����ӷ���ʽΪ ��
����װ��E�е�Ŀ������Cu�����϶�������XΪ ������N�IJ���Ϊ ��
��װ��E��Ŀ������֤�����ĵ绯ѧ��������N�IJ���Ϊ__________________ ��
����װ��A��Cu�缫�����ı�6.4gʱ��װ��D�в������������Ϊ L����״���£���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹ڲ����ɵ�������Ǻ͵���������ɣ�ֱ����Լ��60~140nm���¾ƾ��������¡�����˵����ȷ����
A.������̼���⡢������Ԫ�����
B.�¹ڲ�����ɢ�������в������γɽ���
C.ҽ�þƾ���������������Ϊ����ǿ������
D.���¿�ʹ�����ʷ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com