
【题目】某有机物的结构简式如图,下列叙述不正确的是( ) 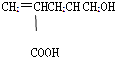
A.1mol该有机物能与足量金属钠反应放出1molH2
B.能与乙醇发生酯化反应
C.1mol该有机物在催化剂作用下最多能与1molH2发生还原反应
D.1mol该有机物能与足量NaHCO3溶液反应放出2 molCO2
【答案】D
【解析】解:A.﹣COOH、﹣OH均与Na反应,则1mol该有机物能与足量金属钠反应放出1molH2 , 故A正确; B.含﹣COOH,能与乙醇发生酯化反应,故B正确;
C.只有碳碳双键与氢气发生加成反应,则1mol该有机物在催化剂作用下最多能与1molH2发生还原反应,故C正确;
D.只有﹣COOH与NaHCO3 , 1mol该有机物能与足量NaHCO3溶液反应放出1 molCO2 , 故D错误;
故选D.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】“绿色化学”要求从根本上减少乃至杜绝污染。下列对我们学习使用的纸张的处理方法,不符合“绿色化学”的是( )
A.一纸多用,尽量提高纸张的使用效率B.回收处理,不乱扔、乱丢废纸屑
C.在高浓度氧气中燃烧,不产生废弃物D.积累、保存送造纸厂处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸480ml。
若实验仪器有: A.10 mL量筒 B.20 mL量筒 C.托盘天平 D.玻璃棒
E.100 mL容量瓶 F.250 mL容量瓶 G.500 mL容量瓶 H.胶头滴管 I.200 mL烧杯
(1)所需浓硫酸的体积为______mL(保留到小数点后一位)。
(2)实验时需选用的仪器有D、I、 ______________________(填序号)。
(3)请将下列各操作,按正确的序号填在横线上(可重复使用)。
A.用量筒量取浓H2SO4;B.反复颠倒摇匀;C.用胶头滴管加蒸馏水至刻度线
D.洗净所用仪器;E.稀释浓H2SO4;F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(4) 配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是(填序号)________。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视读数
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
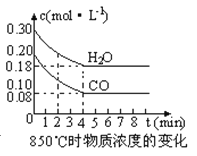
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A,标准状况下的密度为1.25g/L.B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,E有香味.它们之间的转化关系如图1所示: 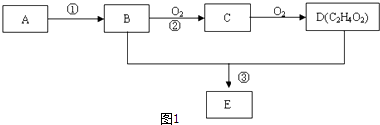
(1)A的电子式为 , D中官能团的名称为 .
(2)以A为原料自身合成高分子化合物的化学方程式为 , 反应类型是 .
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图2所示).观察到的现象是 , 重复操作2﹣3次.写出过程②反应方程式 . 
(4)B、D在浓硫酸的作用下实现反应③,实验装置如图3所示: 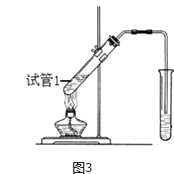
①试管1中实现反应③的化学方程式为 ,
②反应开始时用酒精灯对试管小火加热的原因是: . (已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 常温下电离常数为Ka的酸HA的溶液中c(H+)=![]() mol/L
mol/L
C. 常温下同浓度的强酸和强碱溶液等体积混合后,由水电离出的c(H+)=10-7mol/L
D. 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子。离子浓度均为0.3mol·L-1。某同学进行了如下实验:

下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
C. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
D. 无法确定沉淀C的成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒的作用来清洗伤口。有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
(1)配平下列化学反应,并用单线桥表示电子转移的方向和数目:(配平和单线桥各占分数)
[ ]H2O2+[ ]Cr2(SO4)3+[ ]KOH→[ ]K2CrO4+[ ]K2SO4+[ ]H2O
(2)如消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,
试指出A的化学式 ,如此反应中有6.72L(标准状况)气体生成,转移电子数目为 (用NA表示)。
(3)高锰酸钾也可用于医学杀菌消毒。根据反应条件可判断氧化剂的氧化能力的强弱:例如:
MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O;
MnCl2+C12↑+2H2O;
2KMnO4+16HCl(浓)=2MnCl2+5C12↑+8H2O。
则Mn02、KMnO4氧化性 强。
某强酸反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2 只发生了如下过程:H2O2→O2.则该反应中发生还原反应的过程是:_________→_________,该反应应选择的酸是:_________(填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
(4)用0.2 mol/L Na2SO3溶液32 mL,还原含4×10-3 mol XO42-的溶液,过量的Na2SO3用0.2mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液0.8 mL,则元素X在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验数据,填写下列空白。
(1)一定不存在的离子有___________________。
(2)第②步操作发生反应的离子方程式为_________________________。
(3)第③步操作确定的离子有____________________________。
(4)对无法确定是否存在的离子,满足___________________时,能确定其存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com