
【题目】原子核外p能级、d能级等原子轨道上电子排布为“全空”“半满”“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实不能作为这个规则的证据的是( )
A.硼元素的第一电离能小于铍元素的第一电离能
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态铜原子的核外电子排布式为![]() 而不是
而不是![]()
D.某种激发态碳原子的核外电子排布式为![]() 而不是
而不是![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):

请回答下列问题:
(1)试剂Ⅰ的名称是___a___,试剂Ⅱ中官能团的名称是___b___,第② 步的反应类型是____c___。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A.NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B.NH4Cl水解的化学方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C.Al(OH)3的两性电离方程式:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D.NaHSO3的电离方程式:NaHSO3=Na++HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了如下图装置,反应完毕,电解质溶液的pH保持不变。下列说法正确的是
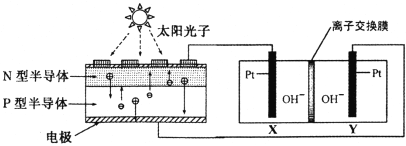
A. 图中N型半导体为正极,P型半导体为负极
B. Y 电极的反应:4OH--4e-=2H2O +O2↑
C. 图中离子交换膜为阳离子交换膜
D. 该装置实现了“太阳能→化学能→电能”的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)=______mol·L-1·min-1。
(2)该反应的化学方程式是______;T℃时,它的平衡常数K=9/16,则2 min时反应______(填“是”或“不是”)平衡状态;已知升高温度时,K增大,则该反应为______(填“吸热”或“放热”)反应。
(3)为了提高反应速率和NO的转化率,可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)在该反应中,HCl表现的性质有______、________.
①MnO2 +4HCl(浓)![]() Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为________(填化学式),被氧化物质的物质的量为 _____,同时转移电子数为_____(用NA表示)。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_________,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。
(4)②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2  2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( )
![]()
A.Y的价层电子排布式是![]()
B.四种元素所形成的最简单氢化物中,沸点最高的是可能Y的氢化物
C.Y、Z之间可形成离子型化合物
D.X、Z、W的最高价氧化物所对应的水化物不可能均是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是

A. 升高温度平衡常数K增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.0.1molC4H4(键线式:![]() )含共价键数目为0.4NA
)含共价键数目为0.4NA
B.30g冰醋酸和乳酸(C3H6O3)的混合物中含氢原子的数目为2NA
C.常温下,0.5mol/L的氨水溶液中氢氧根数目小于0.5NA
D.6.4g铜粉与3.2g硫粉混合隔绝空气加热充分反应,转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com