
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠、氢氧化钠、酚酞 | B. | 氢氧化钠、氢氧化钡、硫酸 | ||
| C. | 硫酸、碳酸钠、氢氧化钠 | D. | 硫酸铜、盐酸、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室常用KMnO4与浓盐酸反应制取氯气:
实验室常用KMnO4与浓盐酸反应制取氯气:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LO2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 标准状况下,1molH2O和1 molH2的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应制氢气 | B. | 过氧化钠与水反应制氧气 | ||
| C. | 氯气与水反应制次氯酸 | D. | 氟单质与水反应制氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)+c(NH3•H2O)=0.1 mol/L | B. | 2c(Fe2+)+c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+):c(Fe2+):c(SO42-)=2:1:2 | D. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO${\;}_{2}^{-}$+2H2↑ | |
| B. | 铜片投入少量FCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C. | .Ca(CHO3)2溶液与足量澄清石灰水混合:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用铁棒作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性:MnO2>Cl2>Br2 | |
| C | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
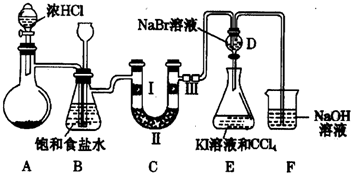
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com