
| A. | ①②③中氧化产物分别是FeCl2、Fe3+、Cl2 | |
| B. | 根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ | |
| C. | 在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 | |
| D. | 根据反应①②一定可以推理得到Cl2+FeBr2═FeCl2+Br2 |
分析 A、在氧化还原反应中,还原剂在反应中失电子(或偏移离子)后被氧化后的产物是氧化产物,化合价升高;
B、在同一个氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性;
C、根据化合价的升降来确定反应转移电子数;
D、在氧化还原反应中,还原性最强的微粒最先被氧化.
解答 解:A、在已知的三个反应中,元素化合价升高的只有I2、Fe3+、C12,所以I2、Fe3+、C12是氧化产物,故A错误;
B、氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,在反应①中,C12>I2,在反应②中,Br2>Fe3+,在反应③中,Co2O3>C12,氧化性顺序是:Co2O3>C12>Br2>Fe3+,故B错误;
C、在反应③中生成1 mol Cl2时,有6mol的盐酸参加反应,其中2molHC1被氧化,故C正确;
D、根据还原性顺序:Br-<Fe2+,C12和FeBr2反应时,氯气先氧化亚铁离子,再氧化溴离子,故D错误.
故选C.
点评 本题考查学生氧化还原反应中,氧化性强弱的判断方法,可以根据所学知识来回答,难度不大.


科目:高中化学 来源: 题型:选择题
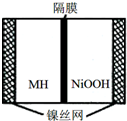 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-+e-═H2O+M | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
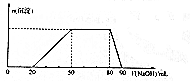 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HNO3>H2CO3>H2SiO3 | B. | 稳定性;H2S>H2O>HF | ||
| C. | 还原性:Cl->Br->I- | D. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲可用于检验乙烯生成 | |
| B. | 装置乙可用于收集和吸收氨气 | |
| C. | 装置丙可用于出去CO2中混有的SO2气体 | |
| D. | 装置丁可分离碘的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
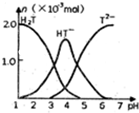 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com