
| A. | F2 | B. | Cl2 | C. | Br2 | D. | I2 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
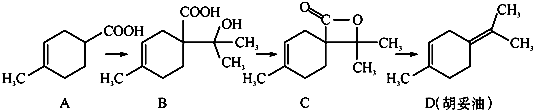
| A. | 从B到C的反应是消去反应 | |
| B. | D分子中所有碳原子一定共面 | |
| C. | 等物质的量的B分别与足量的Na、NaHCO3反应,产生的气体的物质的量前者大于后者 | |
| D. | 若A是由2-甲基-1,3-丁二烯和丙烯酸(CH2=CHCOOH)加热得到的,则该反应的类型属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体:豆浆、墨水、血液、生理盐水 | |
| B. | 单质:冰、液氯、臭氧、红磷 | |
| C. | 混合物:矿泉水、84消毒液、铝热剂、四氧化三铁 | |
| D. | 常见的氧化剂:高锰酸钾、氯气、硝酸、氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式分别为Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
(1)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式分别为Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH溶液和 KHSO4反应H++OH-=H2O | |
| B. | 铜和三氯化铁溶液反应Cu+Fe3+═Fe2++Cu2+ | |
| C. | 金属铝投入NaOH溶液中2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| D. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com