
| A. | 金属铝投入NaOH溶液中:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| B. | 石英与烧碱反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向小苏打溶液中加入过量Ba(OH)2:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
分析 A.电子不守恒;
B.反应生成硅酸钠和水;
C.反应生成氢氧化铝和氯化铵;
D.小苏打完全反应,生成碳酸钡、水、NaOH.
解答 解:A.金属铝投入NaOH溶液中的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故A错误;
B.石英与烧碱反应的离子反应为SiO2+2OH-═SiO32-+H2O,故B正确;
C.氯化铝溶液中加入过量的氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.向小苏打溶液中加入过量Ba(OH)2的离子反应为HCO3-+Ba2++OH-═BaCO3↓+H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| A. | 淀粉、油脂、蛋白质等天然高分子化合物都可以水解 | |
| B. | 某容器内的物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| D. | 质子数为53,中子数为78的点原子可以表达为:${\;}_{53}^{78}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
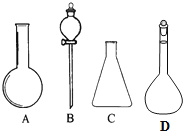 由图所示A、B、C、D四种仪器,回答下列问题.
由图所示A、B、C、D四种仪器,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚遇石蕊显红色 | B. | 食用花生油能发生水解反应 | ||
| C. | 包装用材料聚氯乙烯属于烃 | D. | PX项目中的对二甲苯属于饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 1mol/L FeCl3溶液 | B. | 50mL 0.3mol/L NaCl溶液 | ||
| C. | 10mL 0.2mol/L CaCl2溶液 | D. | 200mL 0.1mol/L NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
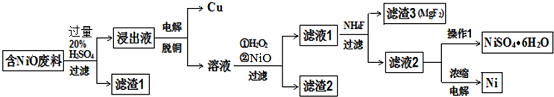
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀 | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
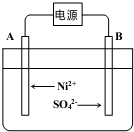
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .第一电离能最小的元素是Cu(填元素符号).
.第一电离能最小的元素是Cu(填元素符号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com