
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
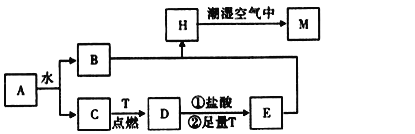
(1)物质A的化学式为___。
(2)H在潮湿空气中变成M的实验现象是__,化学方程式为___。
(3)A和水反应生成B和C的离子方程式为__,列出A的一种重要用途__。
(4)反应①的离子方程式为__,②加足量T的目的___。
【答案】Na2O2 白色沉淀迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2O2+2H2O=4Na++4OH-+O2↑ 供氧剂(或漂白剂) Fe3O4+8H+=Fe2++2Fe3++4H2O 使Fe3+全部还原为Fe2+
【解析】
A为淡黄色固体,且A与水反应生成无色无味C,则A为Na2O2,B为NaOH,C为O2,T为生活中使用最广泛的金属单质,且T与氧气反应生成的D具有磁性的黑色晶体,则T为Fe,D为Fe3O4,四氧化三铁与足量的盐酸、足量的Fe反应得到E,E与B(NaOH)反应得到白色沉淀H,则E为FeCl2,H是Fe(OH)2,H在潮湿的空气中得到M为Fe(OH)3,以此解答该题。
(1)由以上分析可知A为Na2O2,故答案为:Na2O2;
(2)Fe(OH)2在潮湿空气中变成Fe(OH)3的过程中,可能观察到的现象:白色沉淀迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色; 4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)A和水反应生成B和C的离子方程式为2Na2O2+2H2O═4Na++4OH+O2↑,由此反应可知A有作为供氧剂的用途,故答案为:2Na2O2+2H2O═4Na++4OH+O2↑;供氧剂(或漂白剂);
(4)步骤①的反应为四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应的离子方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
②A为淡黄色固体,且A与水反应生成无色无味C,则A为Na2O2,B为NaOH,C为O2,T为生活中使用最广泛的金属单质,且T与氧气反应生成的D具有磁性的黑色晶体,则T为Fe,因此加足量T的目的是为了使使Fe3+全部还原为Fe2+,故答案为:使Fe3+全部还原为Fe2+。


科目:高中化学 来源: 题型:
【题目】某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-。已知相同浓度时的电离度α(H2A)>>α(HA-),现有下列四种溶液:
H++A2-。已知相同浓度时的电离度α(H2A)>>α(HA-),现有下列四种溶液:
①0.01mol·L-1的H2A溶液
②0.01mol·L-1的NaHA溶液
③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液
④0.02mol·L-1的NaOH与0.02mol·L-1的NaHA溶液等体积混合液
下列说法中不正确的是
A.溶液④一定显碱性B.c(H2A)最大的是③
C.c(A2-)最小的是①D.c(H+)最大的是③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下,下列有关说法不正确的是( )
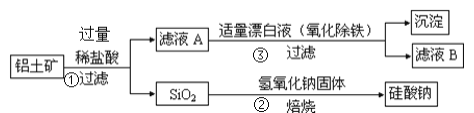
A.向滤液A中加入KSCN溶液,溶液一定会变红
B.![]() 的离子反应方程式为
的离子反应方程式为![]()
C.![]() 漂白液的目的是氧化除铁,该过程中涉及的氧化还原反应为
漂白液的目的是氧化除铁,该过程中涉及的氧化还原反应为![]()
D.![]() 中漂白液要适量,若过量则可能产生有毒的气体氯气
中漂白液要适量,若过量则可能产生有毒的气体氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
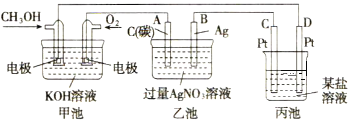
(1)图中甲池是______装置(填“电解池”或“原电池”),其中OH-移向______极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:_______。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式_______。
(4)乙池中总反应的离子方程式_________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是_______(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的成分是 Cu2O,辉铜矿的成分是 Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S + 2Cu2O![]() 6Cu + SO2↑,对于该反应的下列说法正确的是( )
6Cu + SO2↑,对于该反应的下列说法正确的是( )
A.该反应中的氧化剂只有 Cu2O
B.Cu2S 在反应中既是氧化剂又是还原剂
C.Cu 既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为 6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素最常见和最稳定的一种同素异形体是黄色的正交α-型,1912年E.Beckmann由硫在碘中的冰点降低法测得它含有S8分子。1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了一种菱形的![]() -硫,后来证明含有S6分子。下列说法正确的是
-硫,后来证明含有S6分子。下列说法正确的是
A.S6和S8分子都是由S原子组成,所以它们是一种物质
B.S6和S8分子分别与铁粉反应,所得产物不同
C.S6和S8分子分别与过量的氧气反应可以得到SO3
D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
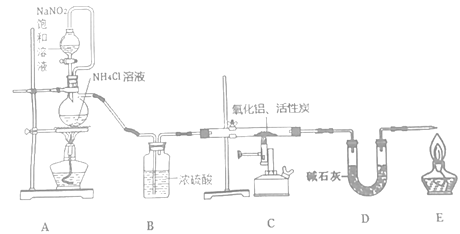
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式:
(1)丙烯的加聚________________________________________;
(2)1,3﹣丁二烯与等物质的量的单质溴在60℃时发生1,4﹣加成_________________________;
(3)1,2﹣二溴乙烷与氢氧化钠水溶液共热________________;
(4)乙醛的还原______________________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com