
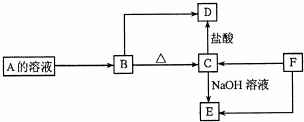
分析 A、B、C、D、E、F为中学化学常见的六种纯净物,其中均含同一种金属元素,A的焰色反应为紫色(透过蓝色钴玻璃观察),说明A含有钾元素,C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,F为单质,F生成C或E,所以F为Al,A可以生成氢氧化铝,且A中含有钾元素,根据中学中常见的物质可知,A应为KAl(SO4)2,结合对应物质的性质解答该题.
解答 解:A、B、C、D、E、F为中学化学常见的六种纯净物,其中均含同一种金属元素,A的焰色反应为紫色(透过蓝色钴玻璃观察),说明A含有钾元素,C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,F为单质,F生成C或E,所以F为Al,A可以生成氢氧化铝,且A中含有钾元素,根据中学中常见的物质可知,A应为KAl(SO4)2,
(1)通过以上分析知,A应为KAl(SO4)2,它的一种用途是作净水剂,观察A的焰色时,蓝色钴玻璃的作用是滤去黄光,
故答案为:KAl(SO4)2;作净水剂;滤去黄光;
(2)B为Al(OH)3,C→E为A12O3和NaAlO2的转化,化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:Al(OH)3;Al2O3+2NaOH═2NaAlO2+H2O;
(3)F为Al,铝在酒精灯上加热时由于表面生成氧化铝,熔点高,而铝的熔点低,所以可以观察到的现象是逐渐熔化,但不滴落,
故答案为:逐渐熔化,但不滴落;
(4)盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是玻璃中的二氧化硅与氢氧化钠反应,反应的离子方程式为SiO2+2NaOH═Na2SiO3+H2O,
故答案为:SiO2+2NaOH═Na2SiO3+H2O.
点评 本题考查无机物的推断,侧重铝及其化合物之间的转化,为高频考点,注意根据B能和强酸、强碱反应且加热易分解推断知,B是氢氧化铝,再结合物质的反应条件、反应物来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe304与稀硝酸反应的离子方程式为:3Fe3O4+28H++N03一═9Fe3++NO↑+14H20 | |
| B. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++C02↑+3H2O | |
| C. | 向NH4Al(S04)2溶液中滴人Ba(OH)2溶液恰好使S042-完全沉淀:2Ba2-+NH4++Al3++2SO42-+40H-═Al(OH)3↓+NH3•H20+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++OH-+HC03-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
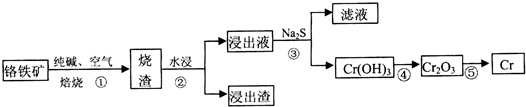 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).| 温度/K | 480 | 505 | 615 | 730 |
| 质量/g | 94.67 | 92.00 | x | 76.00 |
| 化学式 | Cr3O8 | y | CrO2 | Cr2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | NaCl溶液(CuCl2) | 钠 | 结晶 |
| B | S02(SO3) | NaOH溶液 | 萃取 |
| C | Cu(NO3)2溶液(AgNO3) | 铜粉 | 分液 |
| D | 乙醇(水) | … | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂、厨房清洁剂、醋、肥皂 | B. | 醋、厕所清洁剂、肥皂、厨房清洁剂 | ||
| C. | 厕所清洁剂、醋、肥皂、厨房清洁剂 | D. | 厨房清洁剂、醋、肥皂、厕所清洁剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
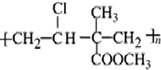 ,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.
,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com