
根据反应:Fe2O3+3CO![]() 2Fe+3CO2,若有3 mol e-转移,则有_______mol 铁生成,有_______个CO分子参加反应。
2Fe+3CO2,若有3 mol e-转移,则有_______mol 铁生成,有_______个CO分子参加反应。
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
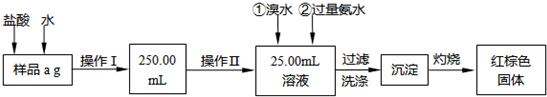
| 112(W2-W1) |
| 160a |
| 112(W2-W1) |
| 160a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
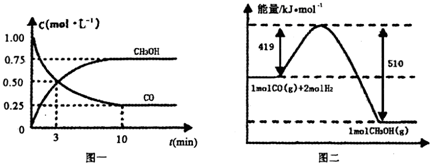
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
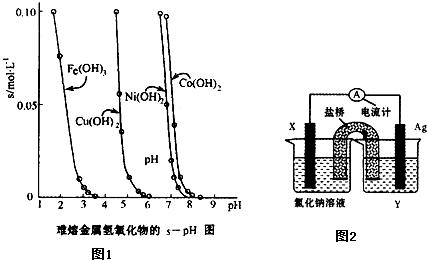
| [CO] | [CO2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com