
| A. | 按系统命名法,化合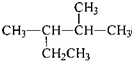 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: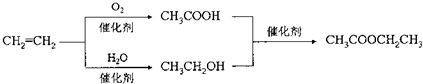 |
分析 A、烷烃的命名应选取最长碳链为主链,最长的主链含5个C;
B、同系物中官能团的种类及数目相同;
C、乙炔的分子式为C2H2,乙醛的分子式为C2H40,据分子式判断耗氧量;
D、以乙烯为原料制备乙酸乙酯,需要将乙烯氧化为乙酸,乙烯与水加成生成乙醇,再通过酯化反应生成乙酸乙酯.
解答 解:A、 的名称为2,3-二甲基戊烷,故A错误;
的名称为2,3-二甲基戊烷,故A错误;
B、甘油是丙三醇,分子中含3个羟基,与甲醇、乙醇不是同系物,故B错误;
C、1mol乙炔燃烧消耗2.5mol氧气,1mol乙醛燃烧也是消耗2.5mol氧气,等物质的量的乙炔、乙醛,完全燃烧时的耗氧量相等,故C错误;
D、以乙烯为原料制备乙酸乙酯,需要将乙烯氧化为乙酸,乙烯与水加成生成乙醇,再通过酯化反应生成乙酸乙酯,即合成路线可为 故D正确;
故D正确;
故选D.
点评 本题考查了烷烃的命名、同系物的判断、有机物燃烧耗氧量的计算、有机合成,题目难度中等.


科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
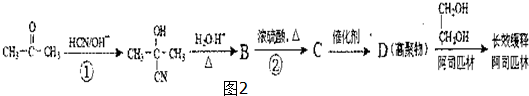
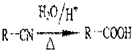 ,回答问题:
,回答问题: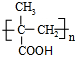 .
.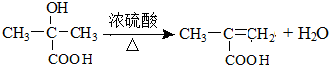 .
.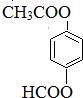 (只写一种).
(只写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数均为K=2 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>Y>X | |
| B. | 气态氢化物的稳定性Z>W | |
| C. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| D. | X的气态氢化物与足量W单质在光照条件下反应所得生成物均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
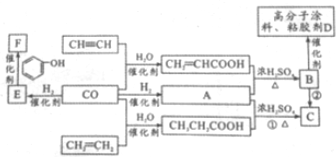
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com